
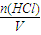 计算盐酸的物质的量浓度.
计算盐酸的物质的量浓度. =0.1mol,
=0.1mol,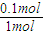 ×22.4L=2.24L.
×22.4L=2.24L.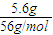 =0.1mol,根据铁原子守恒,可知n(Fe)=n(FeCl2)=0.1mol,
=0.1mol,根据铁原子守恒,可知n(Fe)=n(FeCl2)=0.1mol,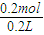 =1mol/L.
=1mol/L.

科目:高中化学 来源: 题型:
| A、反应后的溶液中含有Fe2+、Cu2+、不含Fe3+ | B、反应后的溶液中含有Fe2+ 0.2 mol、Cu2+ 0.1mol | C、反应后的溶液中Fe2+的浓度增至0.3 mol?L-1 | D、反应后容器中残留固体为3.2 g |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
关于硫的下列叙述中,正确的是
[ ]
A.硫比较活泼,所以只以化合态存在于自然界
B.硫与金属或非金属反应均作为氧化剂
C.分离黑火药中的硝酸钾、炭、硫,要用到二硫化碳、水以及过滤操作
D.1.6g硫跟5.6g铁反应能得到7.2g纯净硫化亚铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com