
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应过程 | 反应现象 | 离子方程式 |
| A | 金属镁与稀盐酸反应 | 有气泡逸出 | Mg+2H++2C-═MgCl2+H2↑ |
| B | 氣化钡溶液与稀硫酸反应 | 有白色沉淀生成 | Ba2++SO42-═BaS04↓ |
| C | 碳酸钠与盐酸反应 | 有气泡逸出 | Na2C03+2H+═CO2↑+H20+ 2Na+ |
| D | 硫酸铜溶液中加入过量的NaOH溶液 | 有白色沉淀产生 | Cu2++20H-═Cu(0H)2↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向FeCl2溶液中通入Cl2,然后滴加KSCN溶液 | 验证Cl2的氧化性比Fe3+强 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中不一定含有SO42- |
| C | 用洁净的玻璃棒蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| D | 将某气体通入品红溶液中,溶液褪色 | 该气体中一定含有SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO | |
| B. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+4H++O2↑ | |
| C. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和稀硫酸:Mg+2H+═Mg2++H2↑ | |
| B. | 硅和烧碱溶液:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | NaHCO3溶液和足量Ca(OH)2溶液Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
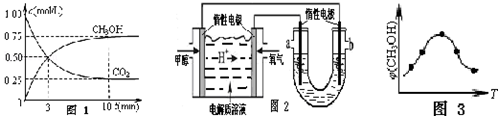
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | a处溶液的pH增大,b处溶液的pH减小 | |
| C. | 一段时间后,a管液面高于b管液面 | |
| D. | 两侧生铁丝发生相同的电极反应:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠与水反应:O2-+2H2O═2OH- | |
| B. | 氯气通入溴化钠溶液中:Cl2+2Br-═2Cl-+Br2 | |
| C. | 硫酸铜溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com