
| A、1 mol硫酸钾中阴离子所带电荷数为NA |
| B、常温下,2.7克铝与足量的稀硫酸反应,失去的电子数为0.1NA |
| C、在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA |
| D、在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物总能量一定低于反应物总能量 |
| B、等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.45 mol?L-1 |
| D、0.225 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ?mol- 1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系,如图所示.以下叙述错误的是( )
(已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ?mol- 1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系,如图所示.以下叙述错误的是( )| A、表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2 (g)△H=-297 KJ?mol-1 |
| B、由Ⅱ到Ⅲ的过程放出的热量为98.3KJ |
| C、恒温恒容时,1molSO2和2molO2 充分反应,放出热量的数值大于78.64KJ |
| D、将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )| A、白磷比红磷稳定 |
| B、红磷转变为白磷是吸热反应 |
| C、白磷燃烧是吸热反应 |
| D、红磷燃烧的热化学方程式可表达为:4P(s)+5O2(g)=P4O10(s),△H=-(E3-E2) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
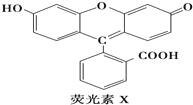
| A、1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH |
| B、1molX最多能与9mol氢气反应 |
C、X能与糠醛(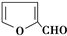 )发生缩聚反应 )发生缩聚反应 |
| D、1molX与足量的浓溴水反应,最多消耗4molBr2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com