
【题目】根据下表给出的几种物质的熔沸点数据,判断下列说法中错误的是
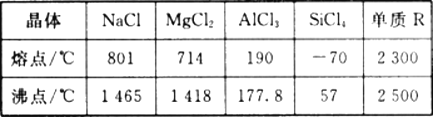
A. SiCl4 和A1Cl3都是分子晶体 ,熔融状态下不导电
B. MgCl2和NaCl都是离子晶体,熔融状态能导电且易溶于水
C. 若单质R是原子晶体,其熔沸点的高低是由共价键的键能决定的
D. 固态时可导电的一定是金属晶体
【答案】D
【解析】
不同晶体的熔沸点比较:原子晶体>离子晶体>>分子晶体。故可以通过晶体的熔沸点判断出该晶体的类型。即NaCl、MgCl2为离子晶体,AlCl3、SiCl4为分子晶体。R可能为原子晶体。
A. 相比之下,AlCl3、SiCl4的熔沸点都很低,可以判断出这两类物质都是分子晶体,熔融状态下不能电离出离子,所以不能导电,A正确;
B. MgCl2和NaCl的熔沸点都较高,可以判断出这两类物质都是离子晶体,熔融状态下可以电离出离子,所以能导电,且这两种物质都易溶于水,B正确;
C. R的熔沸点非常高,若其为原子晶体,则其熔沸点的高低是由共价键的键能决定的:共价键键能越高,该物质的熔沸点也越高,C正确;
D. 固态时可导电的不一定是金属晶体,比如石墨,石墨不是金属晶体,但是石墨可以导电,D错误;
故合理选项为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将agFe2O3、Al2O3的混合固体溶解在200mL0.1mol/L的过量硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为()
A.0.1mol/LB.0.2mol/LC.0.4mol/LD.0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化关系如图所示。下列说法正确的是
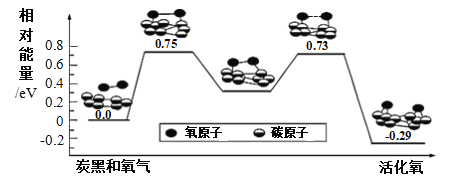
A.O2转化为活化氧与碳氧键生成无关
B.每活化1个O2分子最终吸收0.29 eV能量
C.该过程的最大能垒(活化能)E正= 0.73 eV
D.炭黑可加快SO2转化为SO3的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH4、SF6、二氯乙烯(反式)、H2O2都是含极性键的非极性分子
B. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
C. 酸性:H2CO3<H3PO4<HNO3<HClO4
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )
A.1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuCl2溶液的叙述中正确的是
A. 溶液中存在自由移动的离子:![]()
B. 溶液中:c(Cu2+)+c(H+)=c(Cl-)+c(OH-)
C. 用惰性电极电解该溶液时,阳极有黄绿色气体产生
D. 溶液pH<7 的原因是:Cu2++H2O=Cu(OH)2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
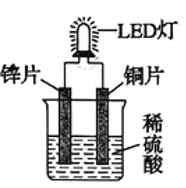
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成蔗糖容液,LED灯将会发光
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com