
| A. | 氯气和二氧化硫都有漂白性,等体积的二者混合会提高漂白效率 | |
| B. | 氢氧化铁胶体在电场的作用下向阳极移动 | |
| C. | 普通玻璃中含有石英、石灰石和纯碱 | |
| D. | 铝制餐具不宜用来长时间存放酸性、碱性或咸的食物 |
分析 A.依据反应SO2+Cl2+2H2O=H2SO4+2HCl,及生成物性质解答;
B.氢氧化铁胶体能够吸附带正电荷离子而形成带正电荷的胶体微粒;
C.玻璃成分为硅酸钠、硅酸钙、二氧化硅;
D.依据铝、氧化铝都能够与酸、碱反应解答.
解答 解:A.氯气和二氧化硫都有漂白性,等体积的二者混合通入水中反应生成硫酸和盐酸,二者不具有漂白性,故A错误;
B.氢氧化铁胶体能够吸附带正电荷离子而形成带正电荷的胶体微粒,在电场的作用下向阴极移动,故B错误;
C.玻璃成分为硅酸钠、硅酸钙、二氧化硅,不含石灰石和纯碱,故C错误;
D.铝、氧化铝都能够与酸、碱反应,所以铝制容器,不耐酸、碱,不宜用来长时间存放酸性、碱性或咸的食物,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉氯气、二氧化硫、氢氧化铁胶体的性质,明确玻璃成分是解题关键,注意基础知识的积累,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压、v正、v逆都增大,且v正大于v逆 | |
| C. | 降温,v正、v逆减小,且v正小于v逆 | |
| D. | 体积不变,加入氮气,v正、v逆都增大,且v正大于v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
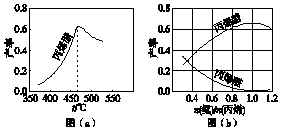 丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:
丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
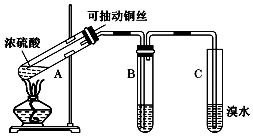 某兴趣小组设计出如图所示装置来改进教材中“铜与浓硫酸反应”实验
某兴趣小组设计出如图所示装置来改进教材中“铜与浓硫酸反应”实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量二氧化碳过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS | |
| B. | 已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 | |
| C. | 已知Na与水反应生成NaOH,推测Fe与水蒸汽反应生成Fe(OH)3 | |
| D. | 已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com