
| A. | 向溶液中加入适量氯化铵固体 | |
| B. | 向溶液中加入一定体积的pH=4的盐酸 | |
| C. | 向溶液中加水至溶液体积为1000mL | |
| D. | 向溶液中加入适量醋酸钠固体 |
分析 10mL0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,pH=1,若使溶液的pH增大2,需要减小氢离子的浓度.
解答 解:10mL0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,pH=1,若使溶液的pH增大2,需要减小氢离子的浓度,
A.向溶液中加入适量氯化铵固体,溶液中氢离子浓度几乎不变,所以不能使pH增大2,故A错误;
B.pH=1的溶液,若使溶液的pH增大2,可以加入一定体积的pH=4的盐酸,故B正确;
C.pH=1的溶液,向溶液中加水至溶液体积为1000mL,体积增大为原来的100倍,则氢离子浓度减小为原来的$\frac{1}{100}$,则溶液的pH增大2,故C正确;
D.pH=1的硫酸溶液,加入醋酸钠,pH增大,所以向溶液中加入适量醋酸钠固体可以使溶液的pH增大2,故D正确.
故选A.
点评 本题考查了弱电解质的电离、混合溶液的定性分析,题目难度不大,注意溶液中pH增大2,则氢离子浓度变为原来的$\frac{1}{100}$.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
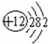 ,⑧
,⑧ ;
;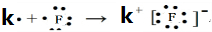 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com