
A、 |
B、 |
C、 |
D、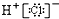 |
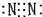 ,故B正确;
,故B正确;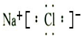 ,故C错误;
,故C错误; ,故D错误,故选B.
,故D错误,故选B.


科目:高中化学 来源: 题型:
| A、当25Cl=0.1V2时;c(A-)>c(B-) |
| B、当PH>7时,;c(A-)>c(OH-) |
| C、当pH=7,且V2=25 时,C1>0.1 |
| D、当PH<7 时,c(B+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 反应①中的能量变化如图所示 |
| B、可推知2H2(g)+O2(g)=2H2O(g)?△H=-483.8 kJ/mol |
| C、1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D、CH3OH转变成H2的过程一定要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5LCH4与5LNH3的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的质量 |
| D、同温、同压下,CO和CO2的密度比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、反应①的平衡常数K1=
| ||
B、反应③的平衡常数K=
| ||
| C、对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 | ||
| D、对于反应③,恒温恒容下,增大压强,H2浓度一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染 |
| B、与铜质水龙头连接处的钢质水管易发生腐蚀 |
| C、发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 |
| D、金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃钢是一种复合材料,由基体和增强体组成,基体起骨架作用 |
| B、SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C、食醋、纯碱、食盐分别属于酸、碱、盐 |
| D、生铁、不锈钢、青铜都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com