

| A、分子中所有的碳原子均可能在同一平面内 |
| B、1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2 |
| C、1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH |
| D、绿原酸水解产物均可以与FeCl3溶液发生显色反应 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其他五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其他五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
| A、a>b>c |
| B、a<b<c |
| C、c<a<b |
| D、a+b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从溴水中提取溴单质--萃取法 |
| B、从含少量氯化钠的硝酸钾固体中提纯硝酸钾--结晶法 |
| C、分离CCl4和H2O--过滤法 |
| D、分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃,能与乙酸混溶)的混合液--蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
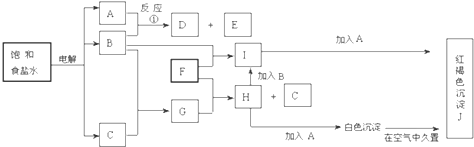
查看答案和解析>>
科目:高中化学 来源: 题型:
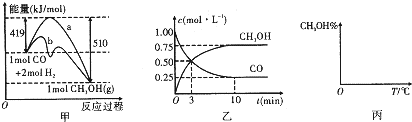
| n(CH3OH) |
| n(CO) |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM 2.5超标对空气质量有重要影响 |
| B、pH<7的降雨称为酸雨 |
| C、酒精可使蛋白质变性,可用于杀菌消毒,浓度越大,灭菌效果越好 |
| D、塑化剂是一种化工塑料软化剂,可大量添加到婴幼儿玩具和高档白酒中,来提高品质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com