
【题目】下列物质中,能使KMnO4酸性溶液褪色的是( )
A.甲烷
B.乙烷
C.乙烯
D.苯
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要用0.50molL-1NaOH溶液和0.50molL-1硫酸溶液完成中和热的测定。
(l)实验桌上备有烧杯(大、小各一个)、泡沫塑料、泡沫塑料板、胶头滴管、硫酸、NaOH溶液,尚缺少的玻璃仪器是____________________________.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写如表中的空白:
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________ |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50molL-1 NaOH溶液和0.50molL-1 硫酸的密度都是1gcm-3,中和后生成溶液的比热容c=4.18Jg-1℃-1.则中和热△H=______(取小数点后一位).
③上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
(3)已知:含1mol CH3COOH的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含1molHCl的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第4周期ⅥA族元素,下列叙述不正确的是( )
A. 硒是一种金属性很强的元素 B. 硒可以形成SeO2和SeO3
C. 硒的氢化物化学式为H2Se D. 硒的最高价氧化物对应水化物的化学式是H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(用化学式回答).
(4)②与④形成的原子个数比为1:2化合物的电子式为 .
(5)⑥的单质与①、④、⑤三种元素形成化合物的水溶液反应的离子方程式为: .
(6)②的最高价氧化物的熔沸点低于⑦的最高价氧化物的熔沸点,原因是 .
(7)⑤元素与⑨元素形成的化合物中,化学键类型为 , 高温灼烧该化合物时,火焰呈色.
(8)在②、③、⑦、⑧单质中,符合下列转化关系的是:(填元素符号).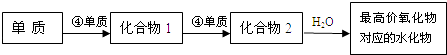
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为 , 质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在298 K、100 kPa时,在1 L水中可溶解0.090 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)在上述平衡体系中加入少量NaCl固体,平衡将向________移动(填“正反应方向”、“逆反应方向”或“不”)。
(3)如果增大氯气的压强,氯气在水中的溶解度将________(填“增大”、“减小”或“不变”),平衡将向________移动。(填“正反应方向”、“逆反应方向”或“不”)
(4)在饱和氯水中加入石灰石可得到较大浓度的次氯酸溶液,请运用学过的化学原理进行解释(酸性:盐酸>碳酸>次氯酸):_______________________;写出氯水与石灰石反应的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活、实验中的行为,符合安全要求的是
A.进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明
B.节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日
C.点燃打火机,可以检验液化气钢瓶口是否漏气
D.实验室里,可以将水倒入浓硫酸中及时用玻璃棒搅拌,配制稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com