
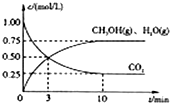
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| △c |
| △t |
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g), CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)| 2.25mol/L |
| 10min |
| 0.75mol/L |
| 1mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.| 实验序号 | KMnO4 溶液体积/mL |
| I | 20.02 |
| II | 19.98 |
| III | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
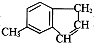 )是一种医药合成中间体,某同学设计它的合成路线如下:
)是一种医药合成中间体,某同学设计它的合成路线如下: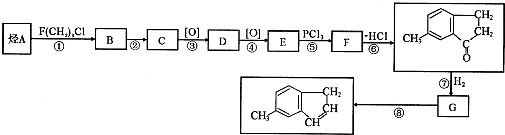
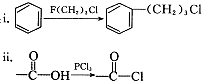
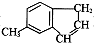 )的说法正确的是
)的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
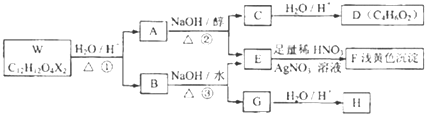

| 醇 |
| 浓H2SO4/△④ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
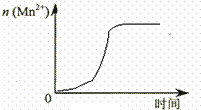 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | t3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com