
分析 (1)酸抑制水的电离,c(H+)越大,水的电离程度越小,以此分析;
(2)从盐类的水解和弱电解质的电离程度角度分析;
(3)③和④等体积混合后,溶液溶质为NaCl和NH4Cl,从盐类的水解角度分析;
(4)根据温度对电解质的电离影响判断温度的大小,根据c(H+)=$\frac{n}{V}$计算酸碱混合反应.
解答 解:(1)酸抑制水的电离,c(H+)越大,水的电离程度越小,硫酸和醋酸的浓度相同,硫酸完全电离,醋酸部分电离,所以硫酸中氢离子浓度大,则硫酸中水的电离程度小,所以①、②、两种溶液中由水电离出的H+浓度由大到小的顺序是①<②;
故答案为:<;
(2)④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O?NH3•H2O+H+,其中硫酸铵溶液中铵根离子浓度最大,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,四种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这五种溶液中NH4+浓度最小,所以有:⑥>⑦>④>⑤>⑧,
故答案为:⑥>⑦>④>⑤>⑧;
(3)⑥为硫酸铵在溶液中电离出铵根离子和硫酸根离子,铵根离子有小部分水解,溶液显酸性,则c(H+)>c(OH-),由于水解程度较小溶液中c(NH4+)>c(SO42-),所以溶液中离子浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-);③和④等体积混合后,溶液溶质为NaCl和NH4Cl,由于溶液中存在:NH3•H2O?NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+),故有:c(Na+)=c(CI-)>c(OH-)>c(NH4+)>c(H+)
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);c(Na+)=c(CI-)>c(OH-)>c(NH4+)>c(H+);
(4)t℃,KW=1×10-13,25℃,KW=1×10-14,已知水的电离为吸热过程,升高温度促进电离,KW增大,所以t℃大于25℃,
t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1×1{0}^{-13}}{1×1{0}^{-11}}$mol/L,
在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,
则有:$\frac{0.1moL/L×bL-1{0}^{-2}mol/L×aL}{(a+b)L}$=0.01mol/L,则a:b=9:2,
故答案为:>;9:2.
点评 本题考查溶液离子浓度大小的比较以及盐类的水解和弱电解质的电离等问题,题目难度中等,注意把握影响盐类水解以及电解质的电离的因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 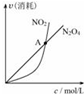 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 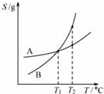 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜丝与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 少量碳酸氢钠与氢氧化钙反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-═H2O | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解加有酚酞的饱和食盐水,由于氢氧根离子向阳极移动,所以阳极区溶液首先变为红色 | |
| B. | 在铁管上镀锌时,铁管与直流电源的正极相接 | |
| C. | 给蓄电池充电时,直流电源的正极与蓄电池的正极相接,发生氧化反应 | |
| D. | 粗铜中含有少量锌、银等金属,电解精炼该粗铜时,阳极只发生的反应是:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
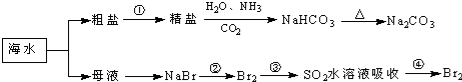
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则平衡时c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砒霜不是碱性氧化物 | B. | Na3As04是可熔性的正盐 | ||
| C. | 砒霜有剧毒,具有还原性 | D. | AsH3是氢化物,稳定性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
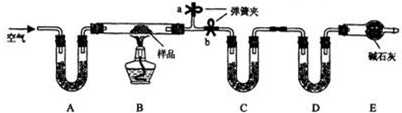
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com