
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.分析 I.(1)白磷和红磷是不同的物质;
(2)白磷变为红磷释放能量;物质能量的高的不稳定性;
(3)根据化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量不同,生成物的能量相同,放出的能量也不同;
Ⅱ.根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液;
负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应.
解答 解:I.(1)因白磷和红磷是不同的物质,白磷变为红磷是化学变化,故答案为:化学;
(2)因白磷变为红磷释放能量,所以白磷具有的能量大于红磷具有的能量,物质的能量越低,稳定性越好,故答案为:>;红磷;
(3)因化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量大,生成物的能量相同,放出的能量也大,故答案为:>;
Ⅱ.根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,则该原电池为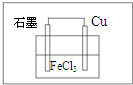 ,负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,则负极反应式为Cu-2e-═Cu2+,正极反应式为2Fe3++2e-═2Fe2+,故故答案为:
,负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,则负极反应式为Cu-2e-═Cu2+,正极反应式为2Fe3++2e-═2Fe2+,故故答案为: ;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+.
;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+.
点评 本题主要考查了原电池的设计、化学反应与物质能量之间的关系,题目难度不大,会根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池中电解质,会正确书写电极反应式,为高考高频点.


科目:高中化学 来源: 题型:选择题
| A. | 引进电动汽车,减少汽车尾气排放 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 积极推行和使用能被微生物降解的新型聚合物材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
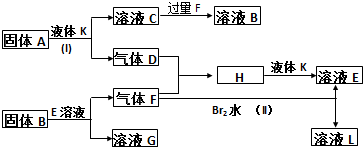
 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
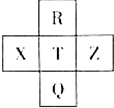 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
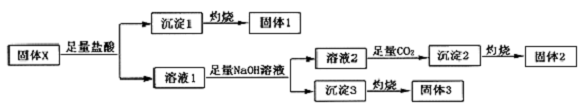
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0 | B. | 等于0 | C. | 大于0 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com