
| A. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| B. | 16O与18O的性质完全不同 | |
| C. | 氯原子的结构示意图 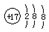 | |
| D. | 碳酸钠的电离方程式:Na2CO3=Na++CO32- |
分析 A.11H、12H、13H是氢元素的三种不同原子,H+是氢元素的离子,H2是氢元素的分子;
B.同位素的性质相似;
C.氯原子的核外有17个电子;
D.电荷不守恒、原子不守恒.
解答 解:A.11H、12H、13H是氢元素的三种不同原子,H+表示氢离子,H2表示氢气分子,是氢元素的五种不同粒子,故A正确;
B.16O与18O是同位素,同位素的性质相似,故B错误;
C.氯原子的核外有17个电子,则氯原子的结构示意图为 ,故C错误;
,故C错误;
D.Na2CO3属于强电解质,溶液中完全电离,钠离子和碳酸根离子,其电离方程式为:Na2CO3=2Na++CO32-,故D错误.
故选A.
点评 本题考查了电离方程式、原子结构示意图、同位素等,题目难度不大,注意把握电离方程式的书写方法和正误判断,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 氢氟酸具有酸性,可用于雕刻玻璃 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | NH3具有还原性,可用NH3与灼热CuO作用制取少量N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
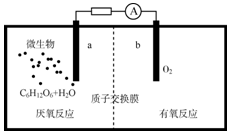
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 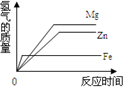 | B. | 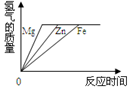 | C. | 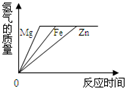 | D. | 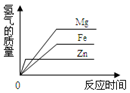 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:W>Y | |
| B. | 最高价氧化物对应的水化物的酸性:X>Z | |
| C. | W的阳离子和Z的阴离子均能促进水的电离 | |
| D. | 由W、Y、Z三种元素组成的化合物既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.078 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 | +5、-3 |
| A. | 简单氢化物的沸点:X>T>Q | |
| B. | 离子半径:X2->T2->L2+>M3+ | |
| C. | 工业上用电解熔融状态的L和T的化合物制取单质L | |
| D. | L、M的最高价氧化物对应的水化物既能与强碱反应又能与强酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com