
| n |
| V |


科目:高中化学 来源: 题型:
| A、A原子的最外层电子数比B原子的最外层电子数少 |
| B、A原子的电子层数比B原子的电子层数多 |
| C、1 mol A与足量酸反应生成的H2比1 mol B与足量酸反应生成的H2多 |
| D、常温时,A能从水中置换出氢,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、Ba(OH)2═Ba2++OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、H2SO4═H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、⑤⑥ |
| C、②③⑥ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
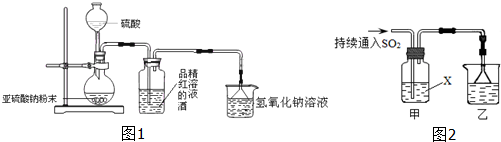
查看答案和解析>>
科目:高中化学 来源: 题型:
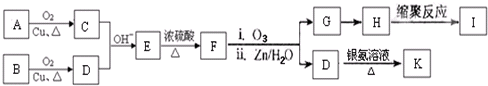
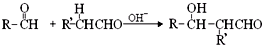 (-R、-R′表示氢原子或烃基)
(-R、-R′表示氢原子或烃基)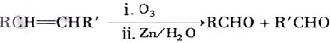
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com