
| A、电池外壳的金属材料回收再利用 |
| B、将地沟油回收再加工为食用油,提高资源的利用率 |
| C、目前我国使用的主要能源是化石燃料,化石燃料属于不可再生能源 |
| D、能源的开发和利用情况,可以衡量一个国家或地区的经济发展和科学技术水平 |


科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1NH3?H2O溶液中:c(NH3H2O)>c(NH4+)=c(OH-)>c(H+) |
| B、0.1 mol?L-1 HCl溶液与0.1 molL-1NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(Cl-) |
| C、0.1 molL-1NaOH和0.1 mol?L-1NH4Cl溶液等体积混合后:c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| D、25℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的平衡常数表达式为K=
| ||
| B、若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ | ||
| C、增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率 | ||
| D、若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
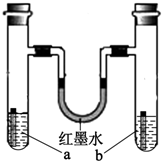 如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )
如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )| A、两块生铁片均发生电化学腐蚀 |
| B、墨水柱两边的液面变为左低右高 |
| C、两试管中相同的电极反应式为Fe-2e-=Fe2+ |
| D、a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电过程中,Li+从负极区向正极区迁移 |
| B、负极反应式:nLi-ne-?nLi+ |
| C、正极反应式:(CF)n+nLi++ne-?nC+nLiF |
| D、可以用水代替有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①表示可逆反应CO(g)+H20(g)?5C02 (g)+H2(g)△H>0 |
| B、图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)影响,乙的压强大 |
| C、图③表示有无催化剂化学反应中能量变化 |
| D、图④表示C02通人饱和碳酸钠溶液中,溶液导电性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com