
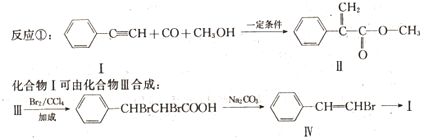
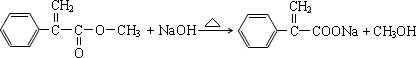 .
.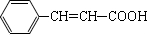 ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.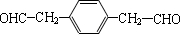 (写一种即可).
(写一种即可).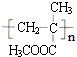 单体的结构简式为
单体的结构简式为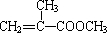 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式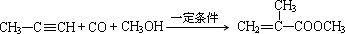 .
. 分析 (1)乙烯、CO和水蒸气合成丙酸,可看作乙烯的加成反应,也为还原反应;
(2)化合物Ⅱ含有酯基,可水解;
(3)化合物Ⅲ可发生加成反应,应含有碳碳双键,化合物Ⅳ含有碳碳双键和溴原子,消去反应生成碳碳三键;
(4)化合物Ⅴ是化合物Ⅱ的同分异构体,其苯环上有两个取代基且能发生银镜反应,说明含有醛基,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1:2,说明结构对称,且含有-CH2-、-CHO;
(5)聚合物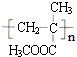 单体为
单体为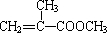 ,可由丙炔、CO和甲醇合成.
,可由丙炔、CO和甲醇合成.
解答 解:(1)乙烯、CO和水蒸气合成丙酸,可看作乙烯的加成反应,也为还原反应,故答案为:还原;
(2)化合物Ⅱ的分子式为C10H10O2,化合物Ⅱ含有酯基,可水解,方程式为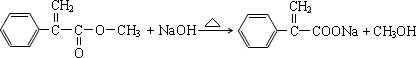 ,
,
故答案为:C10H10O2;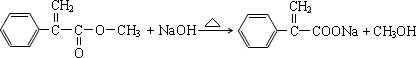 ;
;
(3)化合物Ⅲ可发生加成反应,应含有碳碳双键,由加成产物可知结构简式为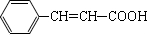 ,化合物Ⅳ含有碳碳双键和溴原子,消去反应生成碳碳三键,方程式为
,化合物Ⅳ含有碳碳双键和溴原子,消去反应生成碳碳三键,方程式为 ,
,
故答案为: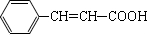 ;
; ;
;
(4)化合物Ⅴ是化合物Ⅱ的同分异构体,其苯环上有两个取代基且能发生银镜反应,说明含有醛基,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1:2,说明结构对称,且含有-CH2-、-CHO,对应结构为 ,故答案为:
,故答案为: ;
;
(5)聚合物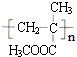 单体为
单体为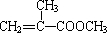 ,可由丙炔、CO和甲醇合成,方程式为
,可由丙炔、CO和甲醇合成,方程式为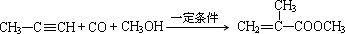 ,
,
故答案为: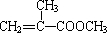 ;
;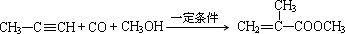 .
.
点评 本题考查有机物的合成,为高考常见题型,侧重于学生的分析能力的考查,答题时注意把握官能团的性质以及题给信息,难度中等.


科目:高中化学 来源: 题型:选择题
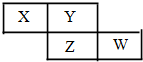 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原理图可理解为两个串联电解装置 | |
| B. | 溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 | |
| C. | 溶液中铁丝左端电极反应式为:Fe-2e-═Fe2+ | |
| D. | 地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
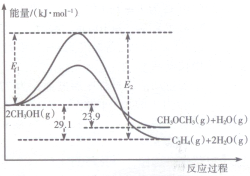 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种意见都支持上述反应为氧化还原反应,且电子转移数相同 | |
| B. | 通过闻生成气体气味可判断反应快慢 | |
| C. | 用稀硫酸可鉴别硫代硫酸钠、亚硫酸钠溶液 | |
| D. | 生成的气体可漂白酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com