
【题目】25℃时,合成氨的反应热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H=—92.4 kJ/mol,下列有关说法正确的是( )
2NH3(g) △H=—92.4 kJ/mol,下列有关说法正确的是( )
A.将1 mol N2和3 mol H2置于一定体积的密闭容器中充分反应可放出92.4 kJ的热量
B.选择高温高压条件下能提高合成氨的产量是符合勒夏特列原理指导实际生产的
C.对于合成氨达平衡时减小压强会使正、逆反应速率减小,但平衡逆向移动
D.在一定体积的容器中合成氨时,当容器内的气体密度不再变化说明反应达到化学平衡状态
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是__________________________。24g金刚石中含有____个碳碳单键。
(2)氧化镁的电子式为_______,CO2的结构式为________。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为________________,其中能量最高的电子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.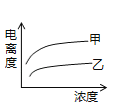
D.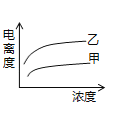
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________mL(假设空气中氧气体积分数为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.碳酸氢钠的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.向明矾溶液中加Ba(OH)2溶液调节pH=12:Al3++SO42-+4OH-+Ba2+═BaSO4↓ +AlO2-+2H2O
C.将锅炉水垢中的硫酸钙用纯碱溶液处理:CaSO4+CO32―=CaCO3+SO42―,
D.Al(OH)3的酸式电离:Al(OH)3=H++AlO2—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制![]()
![]()
![]() 溶液,下列说法不正确的是
溶液,下列说法不正确的是
A.应用托盘天平称取![]() 晶体
晶体![]()
B.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、500mL容量瓶
C.采用加热来加快![]() 晶体的溶解,需趁热迅速将溶液转移至容量瓶中
晶体的溶解,需趁热迅速将溶液转移至容量瓶中
D.定容摇匀后发现溶液液面低于刻度线,不需要再滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Br+H2 HBr+H,其反应的历程与能量变化如图所示,以下叙述正确的是
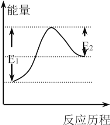
A.该反应是放热反应
B.加入催化剂,E1-E2的差值减小
C.H-H的键能大于H-Br的键能
D.因为E1>E2,所以反应物的总能量高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com