
| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
分析 (CH3)2C=CHCH2CH2C(CH3)=CHCHO中含有碳碳双键,可发生加成、加聚、氧化反应,含有醛基,可发生加成、氧化反应,以此解答该题.
解答 解:A.含有碳碳双键和醛基,都可与氢气发生加成反应,也为还原反应,故A错误;
B.含有碳碳双键,可与溴水发生加成反应,含有醛基,可与溴水发生氧化反应,故B正确;
C.分子中含有2个碳碳双键,而丙烯醛含有1个碳碳双键,不是同系物,故C错误;
D.橙花醛的分子式为C10H16O,与分子式为C10H20O的酮不是同分异构体,故D错误.
故选B.
点评 本题考查有机物的结构和性质,侧重于有机物化合物知识的综合应用,为高考常见题型,注意把握有机物官能团的性质,为解答该类题目的关键,易错点为C,注意分子中能与氢气发生加成反应的种类和数目,题目难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:实验题
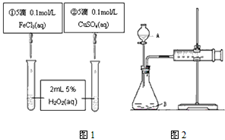 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅常用作半导体材料 | |
| B. | 硅酸钠是制备木材防火剂的原料 | |
| C. | 二氧化硅是制备光导纤维的基本原料 | |
| D. | 硅酸可由二氧化硅与水直接反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +478.7kJ•mol-1 | B. | -764.5 kJ•mol-1 | ||
| C. | -478.7kJ•mol-1 | D. | +764.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | |
| 新制氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com