
| A. | l mol OH-所含电子数为10NA | |
| B. | 2L0.5 mol•L-1Na2SO4溶液中阴离子所带电荷数为0.2NA | |
| C. | 标准状况下,1.12 L CC14含有的氯原子数为0.2NA | |
| D. | 14 g由CO和N2组成的混合气体中含有的分子总数为NA |
分析 A.1个氢氧根离子含有10个电子;
B.硫酸钾溶液中的阴离子除了硫酸根,还有氢氧根;
C.气体摩尔体积使用对象为气体;
D.CO和N2具有相同的摩尔质量为:28g/mol.
解答 解:A.1个氢氧根离子含有10个电子,1 mol OH-所含电子数为10NA,故A正确;
B.硫酸钾溶液中的阴离子除了硫酸根,还有氢氧根,故溶液中的阴离子所带的负电荷的个数大于2NA个,故B错误;
C.标况下四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.14 g由CO和N2组成的混合气体中含有的分子总数为$\frac{14g}{28g/mol}$×NA=0.5NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的分析应用,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/(kJ•mol-1) | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
| A. | Cl2 | B. | Br2 | C. | I2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸使溴水褪色属于氧化反应 | |
| B. | 丙烯酸能发生加成反应但不能发生取代反应 | |
| C. | 丙烯酸分子中所有碳原子不可能处于同一平面 | |
| D. | 反应CH2=CHCOOH+H2$→_{△}^{Ni}$CH3CH2COOH的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 水玻璃、漂白液、液氯均为混合物 | |
| C. | 氨水能够导电,所以氨水是电解质 | |
| D. | 有单质参加或生成的化学反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某溶液中滴加足量盐酸酸化的 BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有SO42- |
| B | 将Cl2通入石蕊试液中 | 石蕊试液先变红 后褪色 | C12具有漂白性 |
| C | 用洁净的铂丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 原溶液一定含有Na+,一定不含K+ 有 |
| D | 将KI和FeCl3溶液在试管中混 合后,加入CC14,振荡,静置 | 下层溶液显紫红 色 | 氧化性Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和硫酸铜溶液反应:2Na+Cu2+═Cu2+2Na+ | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
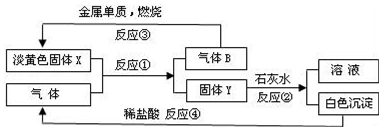
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com