
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
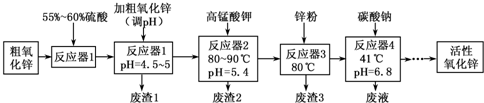
活性氧化锌常用作橡胶制品的硫化活性剂。工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:
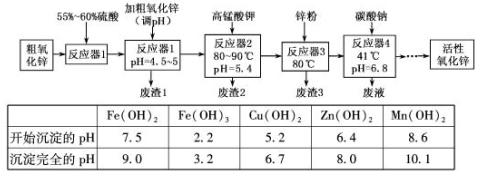
根据上表提供的信息,回答下列问题:
(1)“废渣1”的主要成分是 。
(2)完成“反应器2”中反应之一的离子方程式:
□MnO-4+□Mn2++□ =□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在 试纸上,如果观察到试纸变蓝,说明KMnO4过量。
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)==2MnO(s)+CO2(g)△H=—174.6kJ·mol-1
C(s)+CO2(g)==2CO(g) △H=+283.0kJ·mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式: 。
(5)“反应器3”中加入锌粉的作用是 。
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有 。
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌。取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
。
查看答案和解析>>
科目:高中化学 来源:2011届福建省莆田市高三教学质量检查化学试卷 题型:填空题
(15分)活性氧化锌常用作橡胶制品的硫化活性剂。工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下: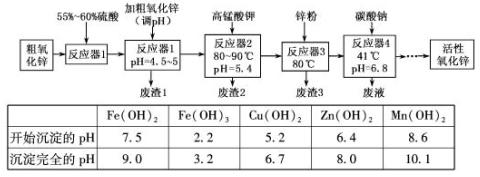
根据上表提供的信息,回答下列问题:
(1)“废渣1”的主要成分是 。
(2)完成“反应器2”中反应之一的离子方程式:
□MnO-4+□Mn2++□ =□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在 试纸上,如果观察到试纸变蓝,说明KMnO4过量。
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)==2MnO(s)+CO2(g)△H=—174.6kJ·mol-1
C(s)+CO2(g)="=2CO(g)" △H=+283.0kJ·mol -1
-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式: 。
(5)“反应器3”中加入锌粉的作用是 。
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有 。
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌。取碱式碳酸锌3.41g,在400~450℃下加热至恒 重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com