
 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;分析 短周期元素中,A是原子序数最小的元素,则A为H元素;B元素原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8,故原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素原子最外层电子数比次外层电子数多3,原子也有2个电子层,最外层电子数为5,故C为N元素;D单质的一种同素异形体是保护地球地表环境的重要屏障,则D为O元素;E元素的最高正化合价为+7,则E为Cl;F是第3周期元素原子半径 最大元素,则F为Na.
解答 解:短周期元素中,A是原子序数最小的元素,则A为H元素;B元素原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8,故原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素原子最外层电子数比次外层电子数多3,原子也有2个电子层,最外层电子数为5,故C为N元素;D单质的一种同素异形体是保护地球地表环境的重要屏障,则D为O元素;E元素的最高正化合价为+7,则E为Cl;F是第3周期元素原子半径 最大元素,则F为Na.
(1)由A、D二元素所形成的原子个数比为1:1的化合物为H2O2,电子式为 ,
,
故答案为: ;
;
(2)E单质为氯气,与水反应的离子方程式:Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)CH4(g)、H2(g)、碳(s)的燃烧热分别为:△H1=-890.3kJ/mol、△H2=-285.8kJ/mol和△H3=-393.5kJ/mol,可得热化学方程式:
①.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
②.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
③.C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
根据盖斯定律,③+②-①可得:C(s)+2H2(g)=CH4(g)△H=-74.8kJ•mol -1,
故答案为:C(s)+2H2(g)=CH4(g)△H=-74.8kJ•mol -1;
(4)C的一种氢化物甲核外有18个电子,甲为N2H4,用N2O4为氧化剂,发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),4gN2H4在上述反应中放出71kJ的热量,则2molN2H4反应放出的热量为:71kJ×$\frac{2mol×32g/mol}{4g}$=1136kJ,故热化学方程式为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1136KJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1136KJ/mol;
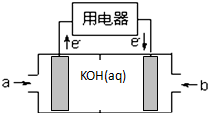
(5)由图可知,通入气体a的一端发生氧化反应,故a为甲烷,该极为负极,甲烷失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4+10OH--8e-=2CO32-+7H2O,通入b为氧气,为正极,获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:4H2O+2O2+8e-=8OH-,
故答案为:CH4;CH4+10OH--8e-=2CO32-+7H2O;正;4H2O+2O2+8e-=8OH-.
点评 本题考查结构性质位置关系应用,涉及电子式、离子方程式、热化学方程式、原电池原理及电极反应式书写,是对学生综合能力的考查,难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
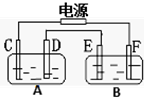
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度氢氧化钠溶液的配制(托盘天平、烧杯、温度计) | |
| B. | 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) | |
| C. | 钠的焰色反应(铂丝、氯化钠溶液、稀盐酸) | |
| D. | 乙酸的酯化反应实验(酒精灯、浓硫酸、浓盐酸) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com