
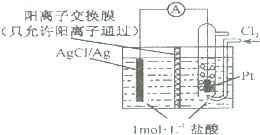
| A、正极反应为Cl2-2e-=2Cl- |
| B、放电时H+从右侧经阳离子交换膜移向左侧 |
| C、电路中转移0.01 mole-时,交换膜左侧溶液中减少0.01 mol离子 |
| D、若用NaCl溶液代替盐酸,电池的总反应不会改变 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
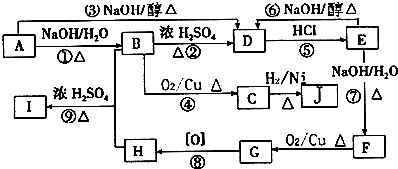
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液. | 出现白色沉淀,说明菠菜中 |
| 步骤2:取步骤1的沉淀于试管中,加入足量 | |
| 步骤3:向步骤2得到的溶液中滴加几滴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
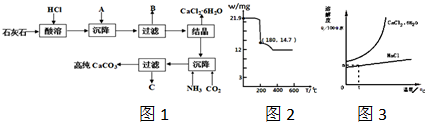
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com