
| 1L×21% |
| Vm |
| 1L |
| Vm |
| 25 |
| 2 |
| 点燃 |
| 点燃 |
| 8x |
| 1+x |
| 8 |
| 1+x |
| ||||
| (1+x) |
| 点燃 |
| 8 |
| 1+x |
| 8x |
| 1+x |
| 1L×21% |
| Vm |
| 1L |
| Vm |
| 32×21% |
| 29 |
| 25 |
| 2 |
| 点燃 |
| 25 |
| 2 |
| 点燃 |
| 25 |
| 2 |
| 3.5088g |
| 23.2% |
| 点燃 |
| 3.3684kg |
| 23.2% |
| 8x |
| 1+x |
| 8 |
| 1+x |
| ||||
| (1+x) |
| 点燃 |
| 8 |
| 1+x |
| 8x |
| 1+x |
| ||||
| (1+x) |
32×
| ||||||
| 114 |
| 200+136x |
| 57+57x |
| n |
| 23.2% |
| (15.12+10.28x) |
| (1+x) |
| (15.12+10.28x) |
| (1+x) |


科目:高中化学 来源: 题型:
| A、过滤 | B、加热 | C、蒸馏 | D、溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| C、NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ |
| D、向FeCl3溶液中加入Ba(OH)2:3Ba(OH)2+2Fe3+═2Fe(OH)3+3Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
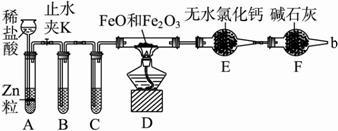
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、Na2CO3 |
| C、CaCl2 |
| D、NaClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com