
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式______。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。该过程中发生反应的离子方程式是____________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如下图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
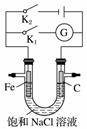
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在指定溶液中能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO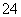
B.1.0 mol·L-1的FeCl2溶液:NO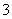 、Na+、K+、ClO-
、Na+、K+、ClO-
C.使酚酞变红的溶液中:Na+、Cl-、SO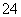 、Fe3+
、Fe3+
D.酸性溶液中:NO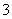 、SO
、SO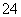 、Fe3+、Mg2+
、Fe3+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;无 |
| B | 铜表面易形成致密的氧化膜 | 铜制容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 向硫酸铜溶液中通入氨气,有深蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体 | 把铜丝放在酒精灯火焰上灼烧,铜丝表面变黑 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO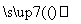 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”
查看答案和解析>>
科目:高中化学 来源: 题型:
在我们的日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为( )。
A.元素 B.单质
C.分子 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中有如下反应: ( )
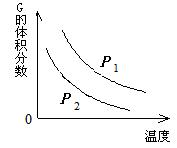 L (s) + a G (g)
L (s) + a G (g) 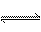 b R (g)
b R (g)
温度和压强对该反应的影响如右图所示,其中压强P1 < P2,
由此可判断( )
A.正反应为放热反应
B.化学方程式中的计量数a > b
C.G的转化率随温度升高而减小
D.增大压强,容器内气体质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com