
【题目】某种电池的正极材料,可通过下列方法制得:①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80℃恒温加热24ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是(用离子方程式表示)
(2)步骤②的反应瓶材质可能是(填序号)
A.玻璃
B.陶瓷
C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为
(4)从安全的角度考虑,在实验室里制三氟化铁时应在中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , Fe2+恰好被完全氧化成Fe3+ , 然后把溶液蒸干,灼烧至恒重得9.6g固体,则该铁氧体的化学式为 .
【答案】
(1)H2O2+2Fe2++2H+=2Fe3++2H2O
(2)C
(3)Fe(OH)3+3HF=FeF3+3H2O
(4)通风橱
(5)FeF3+3Li=Fe+3LiF
(6)2FeO?Fe2O3或Fe4O5
【解析】解:(1)固体铁氧体磁性材料溶于过量盐酸,所得溶液中含有亚铁离子,接着加入H2O2 , H2O2与亚铁离子反应生成三价铁离子,其反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,所以答案是:H2O2+2Fe2++2H+=2Fe3++2H2O;(2)步骤②将沉淀加入反应瓶中,加入过量的氢氟酸溶液反应,由于氢氟酸能与玻璃及陶瓷中的二氧化硅反应,所以反应瓶材质应该为聚四氟乙烯,
所以答案是:C;(3)氢氧化钠与三价铁离子反应生成氢氧化铁,再加HF,生成FeF3和水,则加氢氟酸反生反应的化学方程式为Fe(OH)3+3HF=FeF3+3H2O,
所以答案是:Fe(OH)3+3HF=FeF3+3H2O;(4)HF属于有毒的气体,为了防止中毒,则制备三氟化铁时应在通风橱中进行,所以答案是:通风橱;(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应生成Fe和LiF,该电池反应的化学方程式为FeF3+3Li=Fe+3LiF,所以答案是:FeF3+3Li=Fe+3LiF;(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , 则氯气的物质的量为0.03mol,
由2Fe2++Cl2=2Fe3++2Cl﹣ , 可知Fe2+为0.06mol,则原铁氧体样品中n(FeO)=0.06mol,
把溶液蒸干,灼烧至恒重得9.6g固体为Fe2O3 , 则n(Fe2O3)= ![]() =0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,
=0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,
所以原来溶液中n(Fe3+)=n(Fe)﹣n(Fe2+)=0.12mol﹣0.06mol=0.06mol,则原铁氧体样品中n(Fe2O3)=0.06mol× ![]() =0.03,
=0.03,
所以原铁氧体样品中n(FeO):n(Fe2O3)=0.06mol:0.03mol=2:1,故铁氧体的化学式为2FeOFe2O3或Fe4O5;
所以答案是:2FeOFe2O3或Fe4O5 .


科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
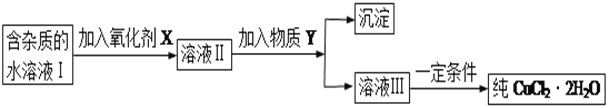
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1molL﹣1 NH4NO3溶液中的氮原子数为0.1NA
B.22g N2O所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.将足量铜加入54.3mL 18.4 molL﹣1浓H2SO4中充分反应产生气体的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
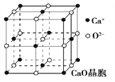
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。
(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.
(1)若A是一种红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 , B在反应中表现出的性质是、 .
(2)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式;实验室检验C的方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A. 晶体熔点的高低: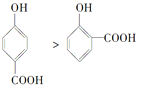
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铁粉反应放出大量氢气,此溶液中可能大量共存的离子组是( )
A.H+、K+、Mg2+、Cl﹣
B.Ba2+、SO ![]() 、Cl﹣、OH﹣
、Cl﹣、OH﹣
C.K+、OH﹣、CO ![]() 、MnO
、MnO ![]() ?
?
D.Ca2+、H+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.在常温常压下,1 mol 氦气含有的原子数为NA
C.常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2NA
D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com