
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A .单质钠的密度比钾的密度小 B.Na+和K+常用作氧化剂
.单质钠的密度比钾的密度小 B.Na+和K+常用作氧化剂
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态
科目:高中化学 来源: 题型:
下列水解离子方程式中,正确的是( )
A.Fe3++3H2O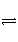
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Br-+H2O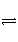
 HBr+OH-
HBr+OH-
C.CO +2H2O
+2H2O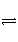
 H2CO3+2OH-
H2CO3+2OH-
D.NH +2H2O
+2H2O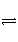
 NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下:①2Na(s) + 1/2O2(g)= Na2O(s) ΔH1= - 414 kJ·mol-1
② 2Na(s)+O2(g) = Na2O2(s) ΔH2= - 511 kJ·mol-1 , 下列说法正确的是 ( )
A.①和②产物的阴阳离子个数 比不相等
比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH= - 317 kJ·mol-1
D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
使5.6 L CO2气体迅速通过Na2O2固体后得到4.48 L(标准状况下)气体,这4.48 L气体的质量是 ( )
A.6.4 g B.8.2 g C.6.2 g D.8.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在做Na2O2与水反应实验时,发现向Na2O2与水反应后的溶液中滴加酚酞试液,溶液呈现 红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大。
丙 :Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是__________________________,验证乙同学的推测是否 正确的方法是_______________________________________
正确的方法是_______________________________________ ______;当出现__________
______;当出现__________ ________________现象时,即可说明丙同学的推测正确。
________________现象时,即可说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学的推测中是否含有H2O2,其实验方法为:称取2.6 g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论 。
。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的______________________________________________________,
理由是_________________________ _________________________________。
_________________________________。
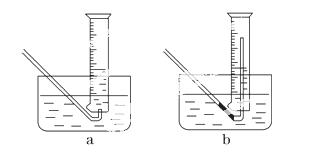
②若在标准状况下测量气体的体积,应选 用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”)。
用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 1 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入 锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
查看答案和解析>>
科目:高中化学 来源: 题型:
将等体积的HnRO3和Hn+1RO4两种酸溶液与定量的NaOH中和都生成正盐,则这两种酸的物质的量浓度比是( )
A.n∶(n+1) B.1∶1
C.1∶(n+1) D.( n+1)∶n
n+1)∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
我省盛产矿盐(主要成分是NaCl,还好有SO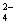 等其他可溶性杂质的离子)。下列有关说法正确的是
等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列氧化还原反应设计一个原电池:2FeCl3+Fe=3FeCl2
要求:(1)画出此原电池的装置图,装置可采用烧杯和盐桥。
(2)注明原电池的正、负极和外电路中电子的流向。
(3)写出两个电极上发生的电 极反应。
极反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com