
| A. | 2014年诺贝尔化学奖授予发明超分辨屏荧光显微镜的科学家,他们使光学显微镜分屏率提高到纳米尺度.利用超分辨率荧光显微镜可以观察到胶体中的胶粒 | |
| B. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排除体外 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国四汽油升级到国v汽油,有助于减少酸雨、雾霾,提高空气质量 |
分析 A.胶体的分散质微粒直径在1~100nm之间;
B.蛋白质含有氮元素;
C.臭氧(O3)有强氧化性;
D.从国四汽油升级到国v汽油可减少污染物的排放.
解答 解:A.光学显微镜分屏率提高到纳米尺度,可看到胶粒,胶体的分散质微粒直径在1~100nm之间,故A正确;
B.蛋白质分解会转变成尿素、二氧化碳和水等而排出体外,故B错误;
C.臭氧(O3)有强氧化性,可用作自来水的消毒剂,故C正确;
D.从国四汽油升级到国v汽油可减少污染物的排放,提高空气质量,故D正确.
故选B.
点评 本题考查胶体、蛋白质的性质、环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
 、
、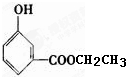 、
、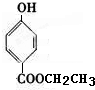 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
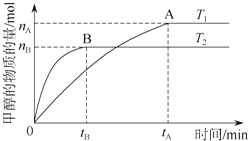 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
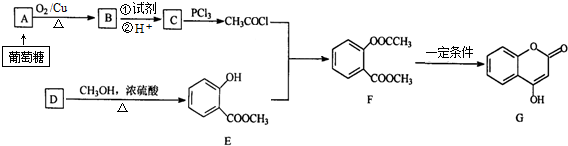
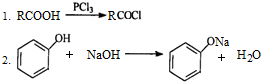
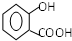 .
.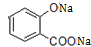 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学是指利用化学原理对已产生的环境污染进行治理 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(${IrO}_{n}^{+}$),在这种离子中n=8 | |
| D. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
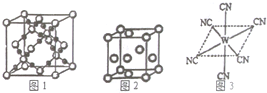 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al14有42个价电子,且与IIA族元素性质相似 | |
| B. | Al13有39个价电子,且与卤素性质类似 | |
| C. | Al13在气相中与HI反应可生成HAl13I,且化学方程式为 Al13+HI=HAl13I | |
| D. | Al13原子中A1原子间是通过离子键结合的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com