
分析 反应3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2中,Fe元素化合价升高,被氧化,H元素化合价降低,被还原,H2O为氧化剂,结合反应的方程式计算相关物质的物质的量.
解答 解:反应3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2中,Fe元素化合价升高,被氧化,H元素化合价降低,被还原,H2O为氧化剂,若消耗了3molFe,由方程式可知有4molH2生成,转移8mol电子;
故答案为:氧化;氧化剂;8 mol.
点评 本题考查氧化还原反应、硅酸盐,题目难度不大,注意把握元素化合价的变化,结合反应的方程式进行计算.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 产生布朗运动 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能穿透半透膜 | D. | 分散质直径在10-7~10-9m之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+c(H2CO3)+c(HCO3-) | |
| C. | ①溶液中:c(CO${\;}_{3}^{2-}$)<c(H2CO3) | |
| D. | ②溶液中:c(HCO${\;}_{3}^{-}$)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、A1O2-、Na+、Cl- | B. | 强碱性溶液:Na+、HCO3-、SO42- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;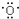 ;
;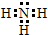 ,结构式为
,结构式为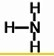 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com