
| A. | 有机物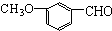 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 | |
| B. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| C. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 | |
| D. | 苯乙烯分子中所有原子可能在一个平面上 |
分析 A、根据有机物属于酯,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-CH2OOCH或-COOCH3、有2个取代基时,有邻、间、对三不同结构;
B、根据酸性高锰酸钾溶液和乙烯反应生成二氧化碳;
C、根据甲酸含有羧基,具有酸性;
D、根据苯、乙烯的平面形结构判断.
解答 解:A、由题目要求可知该有机物的同分异构体中应具有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,应有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-CH2OOCH或C6H5-COOCH3,共6种,故A错误;
B、乙烯可被酸性高锰酸钾氧化生成二氧化碳气体,影响被提纯物质,故B错误;
C、甲酸含有羧基,具有酸性,可用碳酸氢钠溶液鉴别,故C错误;
D、苯、乙烯的平面形结构,则苯乙烯分子中所有原子可能在一个平面上,故D正确;
故选:D.
点评 本题综合考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点以及官能团的性质,难度不大.


科目:高中化学 来源: 题型:解答题
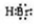 、CaBr2:
、CaBr2: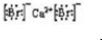 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| C. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性甲比乙弱 | |
| B. | 最高价氧化物的水化物的酸性甲比乙强 | |
| C. | 阴离子的还原性甲比乙弱 | |
| D. | 金属性甲比乙弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所有铵盐受热均可以分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液共热,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物,可用升华法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物在液态时不能导电 | |
| B. | 非极性键也可能存在于离子化合物中 | |
| C. | 双原子分子中的共价键,一定是非极性键 | |
| D. | 分子间作用力,又叫范德华力,它比化学键要弱得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
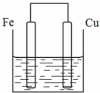 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com