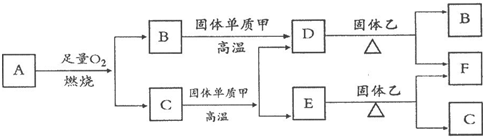
I.气体A只含X、Y两种短周期元素且A分子的空间构型为直线型,最简式为XY气体.常温下B、D、E是常见无色气体,C是无色液体.各物质有如图所示的转化关系.
试回答下列问题:
(1)写出A化学式
C2H2
C2H2
(2)D与固体乙反应过程中,观察到固体乙由黑色变为红色,则乙为
CuO
CuO
(写化学式).
(3)C与黑色固体单质甲在高温下反应的化学方程式为:
.
(4)F的一种氧化物(与F相同颜色)能与KMnO
4溶液反应,生成物中含两种不溶于水的常见物质(不同类型的物质,其中一种常用作催化剂),请写出该反应的化学方程式:
3Cu2O+2KMnO4+7H20=2MnO2+6Cu(OH)2+2KOH或3Cu2O+2KMnO4+H20=2MnO2+6CuO+2KOH
3Cu2O+2KMnO4+7H20=2MnO2+6Cu(OH)2+2KOH或3Cu2O+2KMnO4+H20=2MnO2+6CuO+2KOH
.
II.某研究性学习小组探究铁盐的性质和用途.他们查阅资料知道,可以用铁盐溶解洗涤做过银镜反应实验的试管,原理是:Fe
3++Ag(s)

Fe
2++Ag
+,请回答下列问题:
(1)该小组研究了含有相同物质的量浓度的Fe
3+的FeCl
3和Fe
2(SO
4)
3两种溶液,哪种溶液洗涤效果更好.如果用相同体积的上述两种溶液,你认为
FeCl3
FeCl3
溶液洗涤效果更好,作出该判断的依据是
因为AgCl溶解度比Ag2SO4小,加入FeCl3溶液更有利
因为AgCl溶解度比Ag2SO4小,加入FeCl3溶液更有利
.
(2)甲同学提出,Fe(NO
3)
3溶液也可以做洗涤剂,但乙同学认为用Fe(NO
3)
3溶液做洗涤剂会产生一种红褐色沉淀和一种有毒气体.请写出该反应的离子方程式
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(3)乙同学认为向做过银镜反应实验的试管中的溶液里加入几块铅笔芯也有利于除去银.你认为他的理由是
3Ag+4H++NO3-═3Ag++NO↑+2H2O
3Ag+4H++NO3-═3Ag++NO↑+2H2O




 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:
 用98%的浓H2SO4(ρ=1.84g/cm3)配制 240mL0.5mol/L的稀H2SO4,请按要求填空:
用98%的浓H2SO4(ρ=1.84g/cm3)配制 240mL0.5mol/L的稀H2SO4,请按要求填空:
