
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
分析 石墨为阴极,以Cu为阳极电解KI溶液,通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H++2e-═H2↑,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红;I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu+,则开始生成的Cu+和碘离子反应生成白色不溶于水的固体CuI,据此分析.
解答 解:石墨为阴极,以Cu为阳极电解KI溶液,通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H++2e-═H2↑,破坏了水的电离平衡,使c(OH-)>c(H+),溶液呈碱性,则酚酞试液变红;
I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu+,则开始生成的Cu+和碘离子反应生成白色不溶于水的固体CuI,反应式为2Cu-2e-+2I-═2CuI,所以开始不久,阴极区溶液显红色,而阳极区仍为无色,
故选B.
点评 本题考查电解原理,明确离子放电顺序及电极材料是解本题关键,活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子放电,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、Cl-、AlO2- | D. | K+、Cu2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
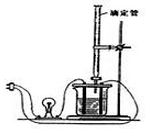 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )| A. | NH3•H2O、AgNO3 | B. | CH3COOH、NH3•H2O | C. | NaOH、AlCl3 | D. | H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
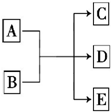 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| (Ⅰ) | (Ⅱ) | |
| A | 少量H2SO4滴入Ba(OH)2溶液中 | 少量NaHSO4滴入Ba(OH)2溶液中 |
| B | 少量NaOH滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入氨水中 |
| C | FeO与足量的盐酸 | FeO与足量的稀硝酸 |
| D | 0.1mol Cl2通入含0.2mol FeBr2的溶液中 | 0.1mol Cl2通入含0.2mol FeCl2的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com