
分析 KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘,如反应存在限度,则反应后溶液中存在本身就少量的Fe3+,可用KSCN溶液检验,以此解答.
解答 解:向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,这是Fe3+的特殊反应,所以可滴加KSCN溶液,溶液显血红色,发生反应Fe3++3SCN-═Fe(SCN)3,说明Fe3+没有反应完,则说明KI和FeCl3的反应有一定的限度,
故答案为:⑤;溶液显血红色.
点评 本题考查化学实验方案的设计,题目难度中不大,明确实验目的为解答关键,注意掌握检验铁离子和亚铁离子的方法,把握可逆反应的特征,试题培养了学生的化学实验能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
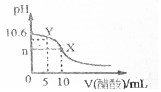 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 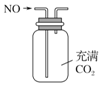 用图所示装置(正放)可收集NO气体 | |
| B. | 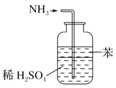 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 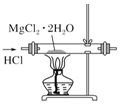 用装置制取无水MgCl2 | |
| D. | 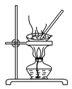 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃属于非金属材料,其主要成分是碳酸盐 | |
| B. | 玻璃钢是一种复合材料,由塑料和铁丝复合而成 | |
| C. | 有机物合成材料属于高分子材料,在汽车轮胎、棉花、塑料制品中都存在 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸>硝酸 |
| B | 向1mL 某溶液中,滴入2mL 0.1mol•L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
| C | 取5mL 0.1mol•L-1FeCl3溶液,滴加5滴0.1mol•L-1KI溶液,振荡,再加入5mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色. | KI和FeCl3反应有一定的限度 |
| D | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com