
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
分析 A.聚乙烯是无毒的高分子化合物;
B.蛋白质在加热条件下可发生变性;
C.Si可做为半导体,二氧化硅是光导纤维的主要成分;
D.明矾具有净水作用,不具有杀菌消毒作用.
解答 解:A.聚乙烯是无毒的高分子化合物,可制作食品包装袋、食物保鲜膜,故A正确;
B.加热可使蛋白质变性而失去活性,故B正确;
C.太阳能电池板的原料是硅单质,光导纤维的主要成分是二氧化硅,故C正确;
D.明矾净水时,铝离子发生水解反应,生成氢氧化铝具有净水作用,发生了化学及物理变化,氢氧化铝不具有氧化性,不能杀菌消毒,故D错误.
故选D.
点评 本题考查聚乙烯、蛋白质的变性、材料、明矾净水等,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| B. | 研发易降解的生物农药有利于环境保护 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 常用无水酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
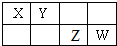 X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )
X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )| A. | X | B. | Y | C. | Z | D. | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
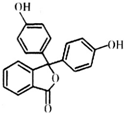 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取少量H2 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  验证Na和水反应为放热效应 | |
| D. |  收集氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com