
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:
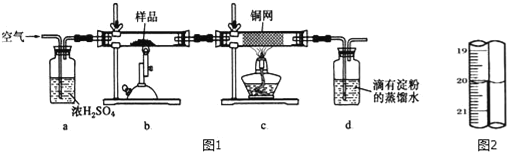
称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.01mL,末读数如图2所示.
完成下列填空:
(1)实验中称量样品所需定量仪器为_____.
(2)装置c的作用是_____.
(3)上述反应结束后,仍需通一段时间的空气,其目的是_____.
(4)滴定时,标准碘溶液所耗体积为_____mL.用化学方程式表示滴定的原理:_____.
(5)计算该黄铜矿的纯度_____.
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.选用提供的试剂,设计实验验证炉渣中含有FeO.提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液,所选试剂为_____.证明炉渣中含有FeO的实验现象为:_____.
【答案】电子天平 除去混合气体中未反应的氧气 将系统装置中SO2全部排入d中充分吸收 20.00 I2+SO2+2H2O=H2SO4+2HI 16% 稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
【解析】
(1)由于称量黄铜矿样品1.150g,精确度达到了千分之一,应该选用电子天平进行称量,把黄铜矿样品研细,可以增大接触面积,从而提高反应速率,并且使黄铜矿充分反应,
故答案是:电子天平;
(2)气体通过装置c中铜网,加热条件下和气体中剩余氧气反应,
故答案为:除去混合气体中未反应的氧气;
(3)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然需要通入一段时间的空气,可以将b、d装置中的二氧化硫全部排出去,使结果更加精确,
故答案为:将系统装置中SO2全部排入d中充分吸收;
(4)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,滴定的原理反应的化学方程式为:I2+SO2+2H2O=H2SO4+2HI,
故答案为:20.00;I2+SO2+2H2O=H2SO4+2HI;
(5)根据硫原子守恒和电子守恒找出关系式:CuFeS2~2SO2~2I2,消耗掉0.01mo1/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.01mol/L×0.0200L=0.000200mol,所以黄铜矿的质量是:![]() ×0.000200mol×184g/mol×10=0.184g,所以其纯度是:
×0.000200mol×184g/mol×10=0.184g,所以其纯度是:![]() ×100%=16%,
×100%=16%,
故答案为:16%;
(6)若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可使KMnO4溶液褪色,则选择试剂为稀硫酸、KMnO4溶液,操作为取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,证明含有FeO,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有: K+、 Na+、Clˉ、CO32ˉ、SO42ˉ等离子,将该固体溶解所得到的溶液进行如下实验:
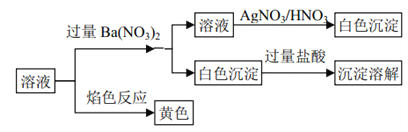
下列说法正确的是
A. 该混合物一定是K2CO3和 NaCl B. 该混合物可能是 Na2CO3和 KCl
C. 该混合物一定是Na2CO3和 NaCl D. 该混合物可能是 Na2SO4和 Na2CO3
【答案】B
【解析】焰色反应呈黄色,说明一定含有Na+;加入过量硝酸钡生成能溶于盐酸的沉淀,原溶液一定含有CO32ˉ,一定不含SO42ˉ;加入过量硝酸钡后的滤液中加入硝酸酸化的硝酸银,生成白色沉淀,则原溶液一定含有Clˉ;根据以上分析,一定含有Na+、Clˉ、CO32ˉ,一定不含SO42ˉ,可能含有K+;所以该混合物可能是 Na2CO3、 KCl或K2CO3、NaCl,故B正确。
【题型】单选题
【结束】
20
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
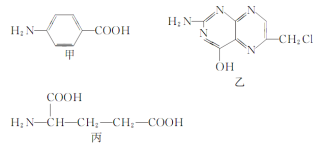
(1)甲中含氧官能团是__________(填名称)。
(2)下列关于乙的说法正确的是________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________。
a.含有![]()
b.在稀硫酸中水解有乙酸生成
(4)写出丁在氢氧化钠溶液中水解的化学方程式。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
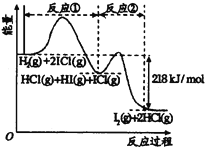
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: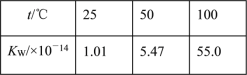
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是
A. NH4+为正四面体形B. SO2 为直线形
C. HCN 为平面三角形D. BF3 为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
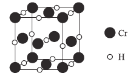
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com