
黄铁矿(Fe2S,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:
3FeS2+8O2![]() 6SO2+Fe3O4
6SO2+Fe3O4
(1)若有标准状况22.4 L O2参加反应,转移电子的物质的量为________.
(2)已知1 g的二氧化硫催化氧化生成气态三氧化硫,放出热量1.536 kJ,请写出该反应的热化学方程式:________.
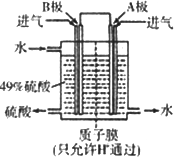
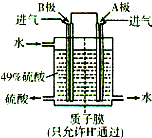
(3)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.请问:B极的电极反应式为________;溶液中H+的移动方向由________极到________极;电池总反应式为________.
科目:高中化学 来源: 题型:
 (2012?潍坊一模)黄铁矿(Fe2S,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
(2012?潍坊一模)黄铁矿(Fe2S,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
| ||
查看答案和解析>>
科目:高中化学 来源:2013届天津市天津一中高三第四次月考化学试卷(带解析) 题型:实验题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2: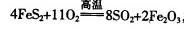 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。) 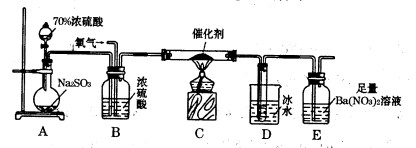
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验: 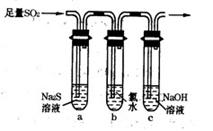
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。)】
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第四次月考化学试卷(解析版) 题型:实验题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
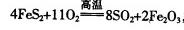 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
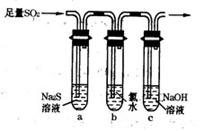
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。)】
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
![]() ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

 ①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
 ④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com