
����ͭ���壬�׳����������������д��£�����ⶾ��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��1���ⶨ�������ھ��������������____________������SO42-��Sԭ�ӵĹ���ӻ���ʽ��____________��H2O�Ŀռ乹����__________________��
��2��������ͭ������ȵ�258~680�����ɵ�����A��A��__________����ѧʽ����A����ˮ�����Һ�����백ˮ���۲쵽��������_____________________________________________�����յõ���Һ�еĺ�ͭԪ�ص�������_________________����ѧʽ���������Ӻ��еĻ�ѧ��������___________________��
��3��������ͭ������ȵ�1000���������ɵ�����C����C�е�ͭ�����ӵĻ�̬�����Ų�ʽ��____________��
��4����ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���������ͺ��������ͬ��ԭ�ӣ���

�ٸ��¶���_______________��
��ͭԭ�ӵ���λ����_______________��
����֪�þ�����ܶ�Ϊdg��cm-3����������_________________pm��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ�����ٿ�ģ�⻯ѧ�Ծ��������棩 ���ͣ��ƶ���
���������·�ߺϳ��л���E(C6H8O4)��(����A����Է���������56��B����Է���������125)��

��1����A�ķ���ʽ�ǣ�D�Ľṹ��ʽΪ______________��
��2���۵ķ�Ӧ������____________��Ӧ��
��3����֪EΪ˳ʽ�ṹ������ṹ��ʽ��____________��
��4������˵����ȷ����____________(�����)
a����Ӧ�����ڼӳɷ�Ӧ
b��B����ȼ��黥Ϊͬϵ��
c��C���������칹��
d��D��ʹ��ˮ��ɫ
��5����Cת��ΪD��������4����Ӧ��ɣ� ��
��
��ܵĻ�ѧ����ʽ��____________������������Լ�����Ӧ������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ������ǰԤ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ijѧ���Լ��Թ�ҵ��ˮ��Ʒ�����о�����ʵ���������۵���������ȷ����( )
A������ˮ������ɫʯ���Լ��м��������
B���ò�����պȡ��ˮ��Ʒ��պ����ʪ��pH��ֽ�ϲⶨ��pH
C����ø÷�ˮ��Ʒ��pH=10�����ˮ��Ʒ��c(OH-)=10-10mol/L
D���ù�ҵ��ˮ��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����5�¸߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
����������(Na2S2O5)������ʳƷƯ�������Ʊ�����������ͼ��

��֪����ӦII����2NaHSO3�TNa2S2O5+H2O�ȶಽ��Ӧ��
��1����ӦI���ܻ�ѧ����ʽΪ____________����ӦI����ʱӦ��ͨ���������____________����ӦI������NH4Cl������____________��
��2������ʱ������Ӧ�Ļ�ѧ����ʽΪ____________��������ʱ�� ��SO21.12��l06 L(��״����)����ת�Ƶ���____________mol��
��3����֪Na2S2O5��ϡ���ᷴӦ�ų�SO2�������ӷ���ʽΪ____________��
��4������ƷX�Ļ�ѧʽ��____________�������������п�ѭ��ʹ�õ�������____________��
��5��Ϊ�˼��ٲ�ƷNa2S2O5�����ʺ���������Ʒ�ӦII���������������ʵ���֮��ԼΪ____________�������Ʒ�к���̼�������������Լ�____________(����)��
�ٳ���ʯ��ˮ �ڱ���̼��������Һ ���������� �����Ը������ ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����5�¸߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�0.2mol•L-1��һԪ��HA���Ũ��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ʾ������˵����ȷ����( )
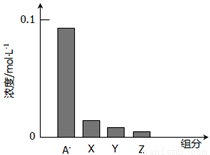
A��HAΪǿ��
B���û����ҺpH=7.0
C��ͼ��X��ʾHA��Y��ʾOH-��Z��ʾH+
D���û����Һ�У�c(A-)+c(Y)=c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶�5���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£�N2O�ֽ�IJ���ʵ���������£� ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c��N2O��/mol•L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
��ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
��ע��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣬c1��c2����ʾN2O��ʼŨ����c1��c2��
A�� B��
B��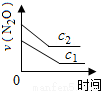 C��
C�� D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶�5���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�û�ɫ��FeCl3��Һ�ֱ��������ʵ�飬���ͻ���۲���ȷ���ǣ� ��
ʵ�� | ���� | ���ͻ���� | |
A | ����FeCl3���� | ��Һ��ɺ��ɫ | FeCl3��ˮ��̶ȱ�� |
B | ��������ˮ | ��Һ��ɫ��dz | c��Fe3+����С |
C | ��������Fe�� | ��Һ��ɫ��dz��ɫ | 2Fe3++Fe=3Fe2+ |
D | ��FeCl3��Һ�� | ��Һ��ɺ��ɫ | ˮ�ⷴӦ��H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ��ͷ�и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
���������л��ϳɵ���Ҫԭ�ϣ�ʵ���Һϳ��������װ��ʾ��ͼ�����ԭ�����������£�
����Ӧ��NaBr+H2SO4 HBr+NaHSO4��C2H5OH+HBr
HBr+NaHSO4��C2H5OH+HBr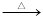 C2H5Br+H2O
C2H5Br+H2O
����Ӧ���ڸ�ʵ���о����������ѡ���ȸ��������ɡ�
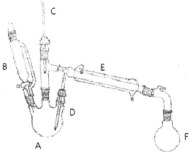
ʵ�鲽�裺
����A���ȼ���5 mL 95������ˮ�Ҵ�(0.085 mol)��4.5 mL��ˮ�������廯��7.725g���ټ����ʯ��ҡ�ȡ��ڽ�����F�м���ˮ��3ml����������������Һ������������ˮԡ�С�
����B�м���9.5 mLŨ����(0.17 mol)����A�л�������Ũ���ᣬ������ϵ�����Ʒ�Ӧ�¶ȣ����ַ�Ӧƽ�ȵط�����ֱ������״�����Ϊֹ��
�۷ֳ����Һ�е��л��㣬����1-2 mLŨ�����Գ�ȥ���ѡ��Ҵ���ˮ�����ʣ���Һ���Էֲ����õ��ֲ��
�ܽ��ֲ���ת������ƿ�У��ӷ�ʯ����ˮԡ�ϼ��������ռ�35-40�����֣�������5.23g��
�ش����⣺
��1������A������Ϊ_________
��2��������ڽ�����F�м���ˮ�Լ���F�����ˮԡ�е�Ŀ����__________������������������Һ��������________________
��3���������Ũ����Ҫ�����μӶ���һ�μ��룬��������________(����)��
a�����Է�ֹ�Ҵ�����̼�� b����������HBr���ٶȹ��죬������ӷ�
c��������Һ�������� d��������Ũ��������HBr�����ɸ�������
��4��������зֳ����Һ���л���IJ�������Ϊ________������Ũ������Ӻ����Һ���Էֲ㣬�ֲ�����________��(��ϡ����¡�)��
��5����ʵ��IJ���Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A�������������ճ��Ƥ���������ϣ������ô�����ˮ��ϴ�����ñ���NaHCO3��Һϴ���������ˮ��ϴ��
B�������е�Ԫ�ص���ȡ�ͼ���ʵ����Ϊ��ȡ�����ҵĽ�ȡҺ����Ҫ���1��2min������ҪĿ���Ǹ�����Һ�е��ܽ�����������������������
C������Fe(NO3)2�����Ƿ����������ʵķ����ǣ���Fe(NO3)2��Ʒ����ϡH2SO4�μ�KSCN��Һ���۲���Һ�Ƿ���
D����Ũ��������һ��Ũ�ȵ�ϡ����ʱ������Ͳ��ȡŨ���ᵹ��ʢˮ���ձ���ϡ�ͣ�����ˮϴ����Ͳ��ϴ��Һһ�������ձ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com