
【题目】氟化锂(LiF)难溶于水,可用于核工业、光学玻璃制造等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如下:
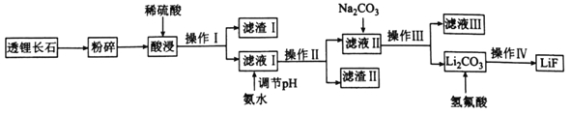
回答下列问题:
(1)滤液I中含有的金属离子有________,滤渣I的一种用途是________________。
(2)滤渣Ⅱ是目前应用最广泛的无机阻燃剂,写出生成滤渣Ⅱ的离子方程式:________________。常温下,若向滤液I中滴加氨水调节pH=5时,溶液中c(Al3+)=________mol·L-1,则溶液中A13+________(填“是”或“否”)沉淀完全(已知Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度小于1.0×10-5mol·L-1时沉淀完全)。
(3)操作Ⅳ包括________________、________________和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式:________________________,该反应不能在玻璃容器中进行的原因是________________________(用化学方程式表示)。
【答案】Li-、Al3+ 制作光导纤维(或制玻璃、制粗硅等,答案正确即可) Al3++3NH3·H2O=Al(OH)2↓+3NH4+ 2.0×10-6 是 过滤 洗涤 Li2CO3+2HF=2LiF+CO2↑+H2O 4HF+SiO2=2H2O+SiF↑
【解析】
通过流程图分析各步发生的化学反应,根据溶度积常数判断沉淀是否完全。
(1) Li2O、Al2O3与硫酸反应生成硫酸锂和硫酸铝,所以滤液I中含有的金属离子有Li-、Al3+ ;滤渣I是二氧化硅,它的一种用途是制作光导纤维,
故答案为:Li2O、Al2O3,制作光导纤维;
(2)滤渣Ⅱ是氢氧化铝沉淀,离子方程式为:Al3++3NH3·H2O=Al(OH)2↓+3NH4+;
c(OH-)=Kw/c(H+)=10-14/10-5=10-9,Ksp[Al(OH)3]= c(Al3+) c3(OH-)= c(Al3+)![]() (10-9)3=2.0×10-33,则c(Al3+)=2.0×10-6mol·L-1,铝离子完全沉淀,
(10-9)3=2.0×10-33,则c(Al3+)=2.0×10-6mol·L-1,铝离子完全沉淀,
故答案为:Al3++3NH3·H2O=Al(OH)2↓+3NH4+;2.0×10-6;是;
(3)由流程图知操作Ⅳ包括过滤、洗涤和干燥,
故答案为:过滤、洗涤;
(4)Li2CO3与氢氟酸发生复分解反应,化学方程式:Li2CO3+2HF=2LiF+CO2↑+H2O;氢氟酸与玻璃种二氧化硅反应,所以不能在玻璃容器中进行,方程式为:4HF+SiO2=2H2O+SiF↑,
故答案为:Li2CO3+2HF=2LiF+CO2↑+H2O;4HF+SiO2=2H2O+SiF↑。


科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖的性质的叙述中,错误的是( )
A.葡萄糖具有醇羟基结构,能跟酸起酯化反应
B.葡萄糖的还原性能使溴水褪色
C.葡萄糖的还原性能被硝酸氧化
D.葡萄糖能水解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是 ________________。W 的气态氢化物能使紫色石蕊溶液变蓝的原因:__________________(用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:_____。
(3)Z 最高价氧化物对应的水化物化学式为 ____。
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.SO2能使KMnO4水溶液褪色
B.可以用澄清石灰水鉴别SO2和CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖3.42 g与淀粉3.24 g混合并完全水解,若生成mg葡萄糖和ng果糖,则m:n为
A. 1:3 B. 1:5 C. 5:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。
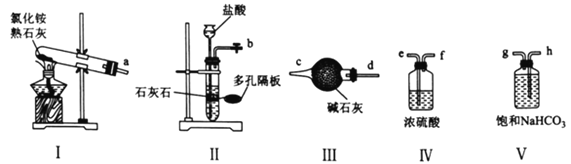
①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:

①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在常温下设计以下实验流程探究Na2S2O3的化学性质。下列说法正确的是

A. 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol·L-1
B. Na2S2O3溶液pH=8的原因用离子方程式表示为S2O32-+2H2O![]() H2S2O3+2OH-
H2S2O3+2OH-
C. 生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需加入稀硝酸验证
D. 实验②说明Na2S2O3具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com