
| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C2H6 | D. | C2H2和C2H6 |
分析 取2.24升该混合气体,完全燃烧得到4.48升二氧化碳和3.6克水,其中混合气体的物质的量为0.1mol,生成二氧化碳的物质的量为0.2mol,水的物质的量为0.2mol,由原子守恒可知混合气体平均分子式为C2H4,结合选项判断.
解答 解:2.24L该混合气体的物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,完全燃烧生成二氧化碳的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,水的物质的量=$\frac{3.6g}{18g/mol}$=0.2mol,则混合气体平均分子式为C2H4,
A.CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故A不符合;
B.CH4和C3H4按照1:1混合,平均分子式为C2H4,故B符合;
C.C2H4和C2H6混合,平均H原子数目介于4~6之间,不可能为4,故C不符合;
D.C2H2和C2H6混合,以任意比混合,平均C原子数目都是2,按照1:1混合时平均H原子数目为4,平均分子式为C2H4,故D符合.
故选BD.
点评 本题考查有机物分子式的确定、混合物计算等,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素Y和Q可形成化合物Y2O3 | |
| B. | T和Z各有一种单质的空间构型为正四面体形 | |
| C. | X的最高价氧化物的立体构型为三角锥型 | |
| D. | ZO2是极性键构成的非极性分子,Z原子的杂化方式为sp杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和一氯甲烷 | B. | 淀粉和纤维素 | C. | 苯和甲苯 | D. | 蔗糖和麦芽糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中含有阴离子的数目为2NA | |
| B. | 3.6g水含有极性键的数目为0.4NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 | |
| C. | 25℃时,在等体积等浓度的氨水、NH4Cl溶液中,Mg(OH)2的Ksp前者小于后者 | |
| D. | 25℃时,在MgF2的悬浊液中通入少量的HF气体,c(Mg2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
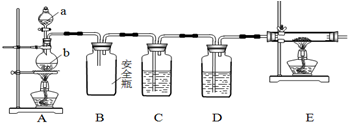
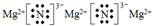 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com