
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 2.23 | 1.0 |
| 2 | 4.46 | ? |
| 3 | 6.69 | 2.5 |
| 4 | 8.92 | 2.5 |
| 2.5g |
| 1.0g |
| 2.5g |
| 1.0g |
| 2.5g |
| 100g/mol |
| 0.025mol |
| 0.25L |
| 1g |
| 100g/mol |
| 1.06g |
| 2.33g |


科目:高中化学 来源: 题型:
| A、①④ | B、③⑤ |
| C、②③④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
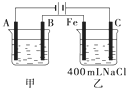 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2++2NO+4H2O |
| B、FeBr2与Cl2物质的量之比为1:1时:2Fe2++2Br-+2Cl2=2Fe3++4C1-+Br2 |
| C、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:A13++2SO42-+2Ba2++4OH-=2BaSO4↓+A1O2-+2H2O |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HC1O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4(s)+4C(s)═BaS(s)+4CO(g)在试问时不能自发进行,说明该反应的△H>0 | ||
| B、常温下,水的电离程度在NH4HSO4溶液中比在纯水中大 | ||
| C、铅蓄电池放电时总反应为PbO2+Pb+2H2SO4═2PbSO4+2H2O,正、负极质量均减小 | ||
D、密闭容器中反应N2+3H2?2NH3,温度不变,增大压强,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.23 mol/L |
| B、0.18 mol/L |
| C、0.26 mol/L |
| D、0.25 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com