
分析 某温度下,SO3(g)?SO2(g)+$\frac{1}{2}$O2(g)△H=+98 kJ•mol-1.可知SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98 kJ•mol-1,当反达到平衡时共放出热量19.6kJ,可知消耗SO2的物质的量为$\frac{19.6kJ}{98kj/mol}$=0.2mol,以此计算平衡时各物质的浓度,则可计算平衡常数.
解答 解:某温度下,SO3(g)?SO2(g)+$\frac{1}{2}$O2(g);△H=+98 kJ•mol-1.可知SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98 kJ•mol-1,当反达到平衡时共放出热量19.6kJ,可知消耗SO2的物质的量为$\frac{19.6kJ}{98kj/mol}$=0.2mol,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
起始(mol)0.40 1.00 0
转化(mol)0.20 0.10 0.20
平衡(mol)0.20 0.90 0.20
平衡浓度(mol/L) 0.02 0.09 0.02
则K=$\frac{0.02}{0.02×0.0{9}^{\frac{1}{2}}}$=$\frac{10}{3}$.
故答案为:$\frac{10}{3}$.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及平衡常数计算,比较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯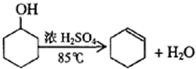
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
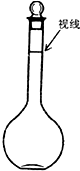 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
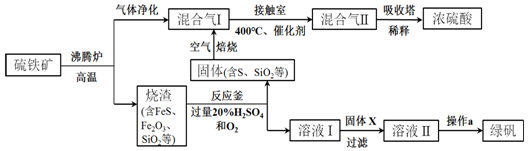
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
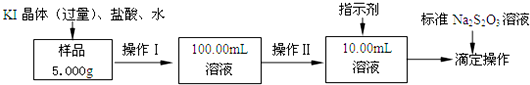
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com