
为了测定某铜银合金的成分,将30.0g该合金溶于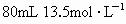 的浓
的浓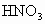 中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的
中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的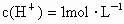 .假设反应后溶液的体积仍为80mL,试计算:(1)被还原硝酸的物质的量.
.假设反应后溶液的体积仍为80mL,试计算:(1)被还原硝酸的物质的量.
(2)合金中银的质量分数.
|
(1) 硝酸被还原后的产物是NO或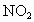 ,因 ,因 被还原得到1molNO或 被还原得到1molNO或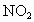 ,因此产生气体的物质的量即是被还原的 ,因此产生气体的物质的量即是被还原的 的物质的量 的物质的量 . .
(2) 因为反应后 ,说明硝酸过量.加反应的硝酸为13.5moL/L×0.080L-1mol/L×0.080L=1mol. ,说明硝酸过量.加反应的硝酸为13.5moL/L×0.080L-1mol/L×0.080L=1mol.
设合金中 Ag的物质的量为x,Cu的物质的量为y.根据其质量为 30.0g,可立方程式:
1mol 参加反应的 中有0.3mol被还原,有0.7mol起酸的作用生成硝酸盐,据此有: 中有0.3mol被还原,有0.7mol起酸的作用生成硝酸盐,据此有:
联立①、②式,解得: x=0.1mol,y=0.3mol.
要学会从化学方程式中分析某些物质所起的作用.例如在反应 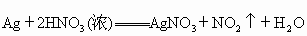 中, 中, 起氧化性和酸性的作用;而在反应 起氧化性和酸性的作用;而在反应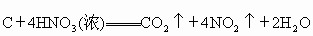 中, 中, 只起氧化性作用. 只起氧化性作用. |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省吉林市普通中学高一上学期期末考试化学试卷 题型:计算题
(6分)为了测定某铜银合金的组成,将30.0g 合金溶于 80.0mL 13.5mol/L 的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标准状况下),并测得溶液中H+的物质的量浓度为1.00 mol/L ,假设反应后溶液的体积仍为80.0 mL。
计算:(1)被还原的硝酸的物质的量
(2)合金中银的质量分数
查看答案和解析>>
科目:高中化学 来源:2011届江西省安福中学高三年级入学考试 题型:单选题
为了测定某铜银合金的成分。将30.0g合金完全溶于80ml 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到NO和NO2的混合气体共6.72L(标准状况),并测得溶液中氢离子浓度为1mol/L。假设反应后溶液的体积仍为80ml。试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省卫辉市高三第一次月考化学试卷 题型:计算题
为了测定某铜银合金的成分。将30.0g合金完全溶于80ml 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到NO和NO2的混合气体共6.72L(标准状况),并测得溶液中氢离子浓度为1mol/L。假设反应后溶液的体积仍为80ml。试计算:
(1)被还原的硝酸的物质的量。[来源:Zxxk.Com]
(2)合金中银的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com