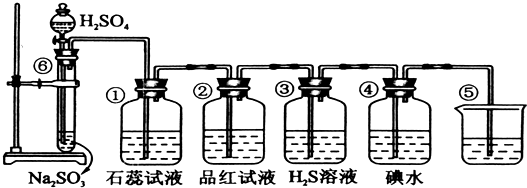
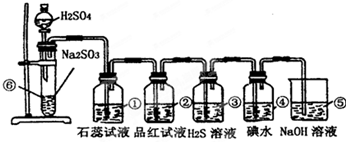
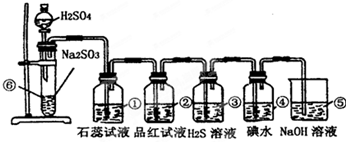
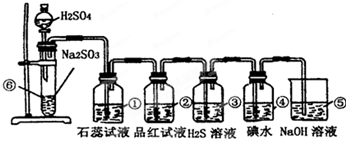
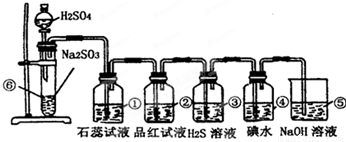
分析:实验室制SO2并验证SO2某些性质,⑥中硫酸与亚硫酸钠反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸;⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,据此进行解答.
解答:解:(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色,
故答案为:石蕊溶液变红;品红褪色;漂白;
(3)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸,该反应为SO2+I2+2H2O═2HI+H2SO4,实验现象为碘水褪色,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性,
故答案为:淡黄色沉淀生成;氧化;还原;
(4)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O.
点评:本题以实验形式考查二氧化硫的制取及性质,题目难度中等,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法.