
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
分析 A、B、C、D、E五种前四周期元素,且原子序数依次增大.周期表中A元素原子半径最小,故A为H元素;B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D位于短周期,其原子的核外成对电子数是未成对电子数的3倍,而短周期中原子单电子处于p能级最多有3个,故其成对电子总数只能为6,单电子数为2,核外电子排布为1s22s22p4,则D为O元素;C元素原子最外层P轨道半充满,原子序数小于氧,故其核外电子排布为1s22s22p3,则B为N元素;E位于ds区且原子的最外层电子数与A的相同,外围电子排布为3d104s1,则E为Cu,据此解答.
解答 解:A、B、C、D、E五种前四周期元素,且原子序数依次增大.周期表中A元素原子半径最小,故A为H元素;B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D位于短周期,其原子的核外成对电子数是未成对电子数的3倍,而短周期中原子单电子处于p能级最多有3个,故其成对电子总数只能为6,单电子数为2,核外电子排布为1s22s22p4,则D为O元素;C元素原子最外层P轨道半充满,原子序数小于氧,故其核外电子排布为1s22s22p3,则B为N元素;E位于ds区且原子的最外层电子数与A的相同,外围电子排布为3d104s1,则E为Cu,
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C;
(2)E为Cu元素,Cu2+的电子排布式为1s22s22p63s23p63d9,故答案为:1s22s22p63s23p63d9;
(3)H2C2O4常用作除锈剂,结构简式为HOOC-COOH,分子中C原子形成3个σ键,没有孤电子对,该分子中碳原子的杂化方式为sp2,单键为σ键,双键含有1个σ键、1个π键,故HOOC-COOH分子中含有7个σ键,1molA2B2D4分子中含有σ键数目为7×6.02×1023,
故答案为:sp2;7×6.02×1023;
(4)原子总数相同、价电子总数相同的微粒互为等电子体,与化合物CO互为等电子体的阴离子化学式为 CN-等,故答案为:CN-等;
(5)C2H6、N2H4分子中均含有18个电子,它们的沸点相差较大,主要原因是:N2H4分子之间存在氢键,故答案为:N2H4分子之间存在氢键;
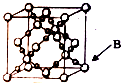
(6)CO2在高温高压下所形成晶体的晶胞中黑色球为O原子,均为晶胞内部,一个该晶胞中含O原子数目为16,故答案为:16.
点评 本题是对物质结构的考查,涉及电离能、核外电子排布、化学键、杂化轨道、氢键、晶胞结构等,注意理解掌握同周期第一电离能异常原因,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验的设计或操作 |
| A | 比较Cl与S元素的非金属性强弱 | 相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH |
| B | 比较Ksp(AgCl)与Ksp(AgI)的大小 | 向AgCl浊液中滴入少量的KI溶液,振荡 |
| C | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| D | 证明氧化性H2O2比Fe3+强 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 电解饱和氯化钠溶液,产生气体:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在苯和液溴的混合物中,添加少量铁屑后马上剧烈反应 | |
| B. | 伸出烧瓶的导管要有足够长度,其作用是导出气体和充分冷凝回流逸出的苯和溴蒸气 | |
| C. | 导管末端应插入锥形瓶内水面以下,有利于HBr气体被吸收 | |
| D. | 反应后烧瓶中是褐色的油状液体,倒入盛有足量浓烧碱溶液的分液漏斗中,充分振荡后静置,上层液体是无色的溴苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com