
【题目】将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是
A. 平衡后氨气的分解率为![]() ×100% B. 平衡混合气体中H2的体积分数为
×100% B. 平衡混合气体中H2的体积分数为![]() ×100%
×100%
C. 反应前后气体的密度比为a/b D. 平衡后气体的平均摩尔质量为17a/b g
【答案】B
【解析】
根据反应2NH3![]() N2+3H2,可以计算出反应达到平衡后,转化的氨气为(b-a)L,反应达到平衡时,氨气的体积为(2a-b)L,氮气的体积为(b-a)/2L,氢气体积为3((b-a)/2L。
N2+3H2,可以计算出反应达到平衡后,转化的氨气为(b-a)L,反应达到平衡时,氨气的体积为(2a-b)L,氮气的体积为(b-a)/2L,氢气体积为3((b-a)/2L。
A项,平衡后氨气的分解率为(b-a)/a×100%,故A项错误;
B 项,平衡混合气体中H2的体积分数为3(b-a)/2b×100%,故B项正确;
C项,设反应前aLNH3的质量为m g,反应前密度为ρ1=m/a,反应后的密度为ρ2=m/b,所以反应前后气体的密度比为b/a,故C项错误;
D项,同温同压下,根据pV=nRT、n=m/M,V=m/ρ得pM=ρRT,所以摩尔质量之比等于密度之比,反应前氨气的摩尔质量为17g/mol,则反应后的摩尔质量为17a/bg/mol,而选项中单位错误,故D项错误;
综上所述,本题正确答案为B。


科目:高中化学 来源: 题型:
【题目】含有6.02×1023个H3PO4 中氧原子的物质的量是( )
A. 1.00 mol B. 0.50 mol C. 4mol D. 0.125 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用高锰酸钾和浓盐酸制取氯气,反应方程式如下:
[___]KMnO4+[___]HCl(浓)→[___]KCl+[___]MnCl2+[___]Cl2+[___]H2O
(1)配平上述反应的化学方程式,并用单线桥标出电子转移方向和数目。__________
(2)反应中,HCl 体现的化学性质为____。
(3)若反应消耗 2molHCl,转移电子数目为_____个。
(4)将SO2气体通入KMnO4溶液中,溶液褪色,生成Mn2+.写出发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A. 10g H2 和10g O2 B. 5.6L N2和11g CO2
C. 9 g H2O 和0.5 molBr2 D. 224mL H2(标况)和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
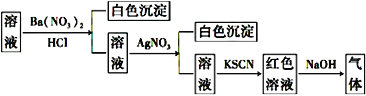
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com