
| 6 |
| 11 |
| 7.5mol |
| 5 |
| 1 |
| 5 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| 主 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、皮肤不慎沾上浓硝酸而呈黄色 |
| B、久置的KI溶液呈黄色 |
| C、盛在无色试剂瓶中的浓硝酸呈黄色 |
| D、食盐撒在燃着液化气的火焰上,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+2 | B、+3 | C、+4 | D、+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,10mL 0.02mol?L-1 HCl溶液与10mL 0.02mol?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| B、0.1mol?L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| C、NH4Cl溶液中:c(NH4+)=c(Cl-) |
| D、0.1mol?L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

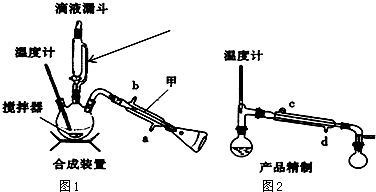
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com