
铬及其化合物应用广泛。例如用经硫酸酸化处理的三氧化铬(CrO3)硅胶测试司机呼出的气体,根据硅胶颜色的变化可以判断司机是否酒驾
(1)基态铬原子的电子排布式为 。
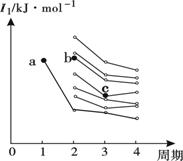
(2)右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(3)测试过程中,乙醇被氧化为乙醛(CH3CHO)。乙醇与乙醛
的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
(4)氯化铬酰(CrO2Cl2)可用作染料溶剂,熔点为-96.5℃,沸点为117℃,能与四氯化碳等有机溶剂互溶。氯化铬酰晶体属于 (填晶体类型)。
(5)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+ 形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(6)在酸性溶液中,H2O2能与重铬酸盐作用生成蓝色的CrO5,离子方程式为:
4H2O2 + 2H+ + Cr2O72- =2CrO5 + 5H2O根据下图所示Cr2O72-和CrO5的结构判断,上述反应 (填“是”或“不是”)氧化还原反应。
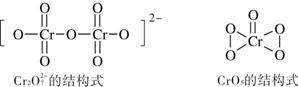
【知识点】核外电子排布、配合物的成键情况、晶体的类型与物质熔点、晶胞的计算
【答案解析】(15分,除标注的外每空2分)(1) [Ar]3d54s1 (2) O Si (3) 乙醇分子间存在氢键,而乙醛分子间不存在氢键 (4) 分子晶体 (1分)
(5) ① A、C ②如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键
(6) 不是
解析:(1)铬是24号元素,根据核外电子排布规律和d轨道半充满的稳定性,原子电子排布式为[Ar]3d54s1(2)第二周期的第一电离能应该是N>O>C因为N的2P轨道半充满比较稳定,第一电离能大。第三周期的中间是硅元素。b、c两点对应的元素分别为O 和Si (3)乙醇分子间存在氢键,而乙醛分子间不存在氢键。氢键作用力远大于范德华力。(4)根据他的熔沸点相对低及溶解性的特点判断为分子晶体。(5)①Cr3+以[Cr(H2O)5Cl]2+ 形式存在,是配位键,不是离子键也不是金属键;②如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键(6)根据图所示Cr2O72-和CrO5的结构判断,铬元素都是形成6个化学键,为+6价,反应前后化合价没变化,所以不是氧化还原反应。
【思路点拨】本题本题目综合性较大,涉及晶体、化学键、杂化轨道、晶胞计算等,注意第一电离能的规律及异常现象,为易错点。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。

已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。

已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
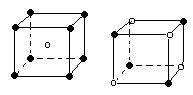 | |||||
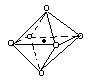 | |||||
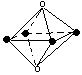 | |||||
⑴ ⑵ ⑶ ⑷
A.图⑴和图⑶ B.图⑵和图⑶ C.只有图⑴ D.图⑴和图⑷
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
| ③ | MnO4- .... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com