
下列有关物质的性质和用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆 B.CO具有还原性,可用于冶炼铁等金属
C.SiO2熔点高,可用作光导纤维 D.Al2O3具有两性,可用作耐高温材料
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年黑龙江省大庆市杜蒙县高一上月考一化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含6.02×1023个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
某溶液中含有Cu2+、Mg2+、Fe2+、Al3+等4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加过量盐酸,溶液中大量减少的阳离子是( )
A.Cu2+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
科目:高中化学 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:填空题
某实验小组研究可逆反应AsO43—+2I—+2H+ AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:
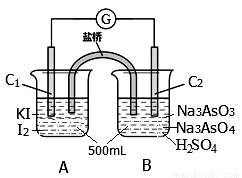
(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下 列判断正确的是 。
列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
A.大于25% B.小于25% c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
一定条件下,碳钢腐蚀与溶液pH的关系如下表,下列说法错误的 是
是
pH | 2 | 4 | 6 | 6.5 | 8 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2— |
A.在pH<4的溶液中,碳钢主要发生析氢腐蚀
B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀
C.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
D.在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4H++4e—═2H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:推断题
短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正化合价和最低负化合价的绝对值之差为2;1 mol C单质与冷水反应,在标准状况下生成11.2 L H2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)用元素符号表示各元素A________、B_________、C_________、D__________、E_________;
(2)能形成共价键的元素
(3)A的单质的电子式为______________
(4)C和B形成化合物的电子式__________
(5)写出C与水反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:选择题
SO2是一种大气污染物,可用NAOH溶液除去,下列有关解释的方程式不合理的是
A.SO2在大气中能最终生成H2SO4:2SO2+O2+2H2O=4H++2SO42-
B.少量SO2与NAOH溶液反应的离子方程式是:SO2+OH-=HSO3-
C.NAOH溶液缓慢吸收过量SO2的过程中有:SO2+SO32-+H2O=2HSO3-
D.n(SO2):n(NAOH)=1:2时,溶液pH>7:SO32-+H2O HSO3-+OH-
HSO3-+OH-
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省双鸭山市高三月考二化学试卷(解析版) 题型:选择题
已知温度 T 时水的离子积常数为 Kw,该温度下,将浓度为 amol/L 的一元酸HA 与 bmol/L 的一元碱 BOH 等体积混合,可判断该溶液呈中性的依据是:
A.a=b
B.混合溶液的 pH 值为 7
C.混合溶液中C(H+)=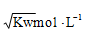
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com