
【题目】有五种物质:①苯、②聚氯乙烯、③丙烯、④对﹣二甲苯、⑤1﹣丁炔,既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应使之褪色的是
A. ②③ B. ①④ C. ③⑤ D. ④⑤
科目:高中化学 来源: 题型:
【题目】改变a1mol/L元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示,已知[δ(X)= ![]() ]。
]。
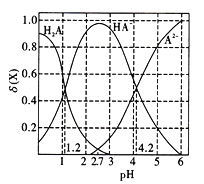
下列叙述错误的是
A. lg[K2(H2A)]=-4.2;pH=2.7时,c(HA-)>c(H2A)=c(A2-)
B. pH=4.2时,c(HA-)=c(A2-)>c(H+);随着pH的升高,c(HA-)/c(H2A)的比值先增大后减小
C. 0.1mol/L的NaHA溶液中存在:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol/L
D. pH=1.2时,c(H2A)=c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10mL浓度均为0.1mol/LNaOH和NH3H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
【答案】B
【解析】试题分析:A、在氢氧化钠和氨水的混合溶液中,氢氧化钠电离出等浓度的氢氧根离子和钠离子,氨水也电离出氢氧根离子,所以氢氧根离子浓度大于钠离子浓度,但一水合氨的浓度小于钠离子浓度,错误,不选A;B、加入10毫升盐酸,与氢氧化钠反应恰好生成氯化钠和水,钠离子浓度与氯离子浓度相等,根据电荷守恒可知,c(NH4+) +c(H+)+ c(Na+)=c(OH-) + c(Cl-) ,推出c(NH4+) +c(H+) =c(OH-),正确,选B;C、当溶液为中性,根据电荷守恒可以推出c(NH4+) + c(Na+)=c(Cl-),错误,不选C;D、当加入20毫升盐酸时溶液为氯化钠和氯化铵,显酸性,c(H+)>c(OH-)根据电荷守恒c(NH4+) +c(H+)+ c(Na+)=c(OH-) + c(Cl-)可知c(Cl-) >c(NH4+) +c(Na+),错误,不选D。
考点:溶液中的离子浓度的大小比较
【名师点睛】溶液中的离子浓度大小比较时,需要考虑电解质的电离和水解情况,有时候需要根据电荷守恒或物料守恒进行分析。物料守恒是指电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。电荷守恒指电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
【题型】单选题
【结束】
21
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为![]() ,则两者的关系正确的是( )
,则两者的关系正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种元素为同一周期ⅡA和ⅢA元素,若A元素的原子序数为x,则B元素的原子序数可能为( )
①x+1 ②x+21 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.①③B.②④C.①③⑤D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是

实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 高锰酸钾 | 淀粉碘化钾溶液 | 溶液会变蓝 |
C | 稀盐酸 | 碳酸钙 | 氯化钡溶液 | 有白色沉淀生成 |
D | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化碳转化为乙烯的装置如图所示,使用的电极材料均为惰性电极。下列说法正确的是( )
A. a为电源的正极 B. 每生成0.1mol乙烯,同时生成6.72LO2
C. 阴极反应式为2CO2+12H++12e-=C2H4+4H2O D. 电解过程中,阳极区溶液中c(H+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.l mol/L,下列说法正确的是( )
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25 mL 0.1 mol/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH变化最大的是④
D. 升高温度,③溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
石墨、石墨烯及金刚石是碳的同素异形体。
(1) 以Ni—Cr—Fe 为催化剂,一定条件下可将石墨转化为金刚石。基态Fe原子未成对电子数为____________。设石墨晶体中碳碳键的键长为a m,金刚石晶体中碳碳键的键长为bm,则a_____b(填“>”、“<”或“=”),原因是_______________________________。
(2)比较下表碳卤化物的熔点,分析其熔点变化规律的原因是____________。
CCl4 | CBr4 | CI4 | |
熔点/℃ | -22.92 | 48.4(α型) | 168(分解) |
(3) 金、铜、锌等金属或合金常用作化学气相沉积法获取石墨烯的催化剂。左下表是铜与锌的部分电离能数据,对于“I1铜小于锌,而I2铜却大于锌”的事实,原因是_________________。
电离能/kJ·mol-1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |

(4)金刚石的晶胞如上图所示。已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为___________________________。
(5)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。

①在图乙所示的氧化石墨烯中,取sp3杂化形式的原子有_________________(填元素符号);
②石墨烯转化为氧化石墨烯时,1号C 与相邻C原子间键能的变化是_____________(填“变大”、“ 变小”或“不变”)。
(6)石墨烯具有很大的比表面积,可望用于制超级电容器。若石墨烯中碳碳键的键长为am,12 g单层石墨烯单面的理论面积约为___________m2(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com