
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有 键的数目为 。
键的数目为 。
(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是 。

(12分)
A:(1)C<O<N(2分)
(2)N≡C-C≡N (2分) 4NA(或2.408×1024)(2分)
(3)3d54s1 (2分) 分子(2分)
(4)CuH(2分)
【解析】
试题分析:A为C、B为N,C为O,D是Cr,E为Cu,⑴同一周期第一电离能由小变大,其中N的2P轨道是半满状态,第一电离能变大,答案:C<O<N;CN― 与N2为等电子体,C与N之间形成叁键,结构式为N≡C-C≡N,其中每个分子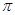 键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1 、
分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1 、
分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
考点:电子排布、原子轨道杂化类型与空间构型、等电子体原理


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:022
已知A、B、C是短周期的三种元素的原子A原子核外电子数是电子层数的3倍,B原子最外层电子数是次外层电子数的3倍,含A元素的化合物种类最多,C原子核外电子数与电子层数相同.
(1)画出原子结构示意图A________,B________.
(2)写出B和C形成两种化合物的电子式________,________.
(3)写出A和C形成的化合物中,n(A)∶n(C)=1∶1的物质的结构简式________.
(4)在B元素和钠元素所形成的化合物中,有一种化合物含有非极性共价键,写出其电子式________.
查看答案和解析>>
科目:高中化学 来源:海淀区2005年高三年级第一学期期末练习 化学 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,B和C的原子序数之和是A的原子序数的3倍,B和C形成的离子具有相同的电子层结构.试回答下列问题:
(1)三种元素的名称是:A________,B________,C________.
(2)由A和B形成的含有非极性键的离子化合物的电子式是________.
(3)B离子半径(填“<”或“>”)________C离子半径,B离子的氧化性比C离子的氧化性________(填“强”或“弱”),B和C元素最高价氧化物的水化物之间反应的离子方程式为________.
(4)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)三种元素的名称是:A____________,B____________,C____________。
(2)由A和B形成的含有非极性键的离子化合物的电子式是____________。
(3)B离子半径(填“<”或“>”)____________C离子半径,B离子的氧化性比C离子的氧化性____________(填“强”或“弱”),B和C元素最高价氧化物的水化物之间反应的离子方程式为__________________________。
(4)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com