
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,电子排布式_____。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:____、____、____。
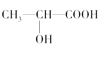
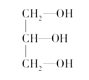
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。____
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)____。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4____H2SO3;HClO3____HClO4;H3PO4___H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
NH3中心原子的杂化方式为___杂化,VSEPR构型为__,分子的立体构型为____。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于____。
【答案】![]() 1s22s22p63s23p63d14s2 Co3+ CN- 6
1s22s22p63s23p63d14s2 Co3+ CN- 6 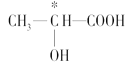 ①③④⑦ > < > sp3 正四面体形 三角锥形 水分子之间除了有范德华力还有氢键,而硫化氢分子之间只有范德华力
①③④⑦ > < > sp3 正四面体形 三角锥形 水分子之间除了有范德华力还有氢键,而硫化氢分子之间只有范德华力
【解析】
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,则另外两个价电子位于第四能层的s轨道,即价电子排布式为3d14s2,所以该元素核外价电子排布图为![]() ,电子排布式为1s22s22p63s23p63d14s2。
,电子排布式为1s22s22p63s23p63d14s2。
(2)K3[Co(CN)6]中的中心离子为Co3+,配位体是CN-,配位数为6。
(3)手性碳原子是连接4个不同的原子或原子团的碳原子。在给出的羟基酸里,连接羟基和羧基的碳原子是手性碳原子,而在丙三醇里,三个碳原子都不符合手性碳原子的条件。故答案为: 。
。
(4)非极性分子是正负电荷中心重合的分子。CO2是直线形分子,两个氧原子在碳原子的两侧对称排列,正负电荷中心重合,是非极性分子;NH3是三角锥形分子,氮原子在锥顶,3个氢原子在锥底,正电荷的中心在3个氢原子形成的三角形的中心,负电荷的中心即为氮原子,正负电荷中心不重合,为极性分子;CCl4是正四面体,碳原子在正四面体的中心,氯原子在正四面体的顶点,正负电荷中心重合,是非极性分子;BF3是平面三角形结构,B在三角形的中心,正负电荷中心重合,是非极性分子;H2O是V形分子,两个氢连线的中点是正电荷的中心,氧原子是负电荷的中心,正负电荷中心不重合,是极性分子;SO2和水一样,是V形分子,是极性分子;SO3和BF3一样,是平面三角形分子,是非极性分子;PCl3和NH3一样,是三角锥形分子,是极性分子,所以属于非极性分子的是①③④⑦。
(5)可以把含氧酸写成(HO)mROn,如果成酸元素相同,则n值越大,R的正电性越高,导致R—O—H中的O的电子向R偏移,因而在水分子的作用下,容易电离出H+,所以酸性:H2SO4>H2SO3;HClO3<HClO4;H3PO4>H3PO3。
(6)NH3中心原子N的价层电子对为3+1/2(5-3×1)=4,所以杂化方式为sp3杂化,VSEPR构型为正四面体,氮原子有一个孤电子对,分子的立体构型为三角锥形。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,是由于水分子间除了有范德华力外,还存在氢键,而硫化氢分子间只有范德华力。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理、装置、操作或结论的描述,错误的是

A. 图1所示装置可实现甲烷与氯气在光照条件下的取代反应
B. 图2所示装置可分离CH3COONa溶液和CH3COOC2H5的混合液
C. 图3是原电池装置,有明显的电流
D. 图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体甲;B在空气中加热熔化但不滴落;C在一定条件下与水蒸气反应生成H2和一种黑色固体。
请根据以上信息回答下列问题:
(1)写出下列物质化学式:A_________B_________C_________甲_________
(2)按要求写出方程式:
①A在空气中燃烧的化学方程式:___________________________________________
②B与氢氧化钠溶液反应的离子方程式:_____________________________________
③C与水蒸气反应的化学方程式:___________________________________________
④甲与水反应的化学方程式:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从含有铁的氧化物及少量FeS、SiO2的烧渣中分离出二氧化硅并制备绿矾(FeSO4·7H2O)固体,实验过程如下:

已知:一定条件下固体硫可溶于氢氧化钠溶液。请回答:
(1)步骤①中,试剂X应采用________。
(2)制备绿矾时,向溶液1中加入过量试剂Y,充分反应后,经________操作得到溶液2。
(3)设计简单实验方案验证步骤②得到的SiO2固体中不含S________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
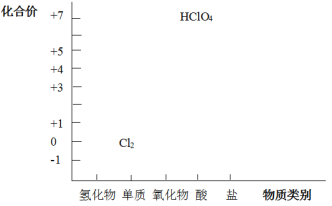
(1)根据图中信息,写出任意一种氯的氧化物的化学式_____。
(2)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的化学方程式_____________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
A.0.1mol·L-1 CH3COONa溶液与0.1mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)
B.0.1mol·L-1NH4Cl溶液与0.1mol·L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-) >c(H+)
C.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物共9g,平均相对分子质量为22.5。使混合气通过足量溴水,溴水增重4.2g,则混合气中的烃可能是( )
A.甲烷和乙烯B.甲烷和丙烯C.乙烷和乙烯D.乙烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是
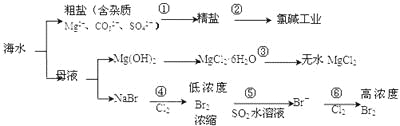
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.工业上通过电解饱和MgCl2溶液制取金属镁
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com